Được hình thành từ phản ứng của axit nitric (HNO3) với kim loại, muối nitrat không còn là thuật ngữ xa lạ với những người yêu thích Hóa học. Muối nitrat xuất hiện phổ biến không chỉ trong các dạng bài tập Hóa học mà còn ở thực tiễn đời sống. Trong bài viết này, Monkey sẽ cùng bạn khám phá chủ đề này, tìm hiểu muối nitrat là gì, lý thuyết chi tiết và thực hành một số bài tập cơ bản.
.png)
Định nghĩa muối nitrat là gì?
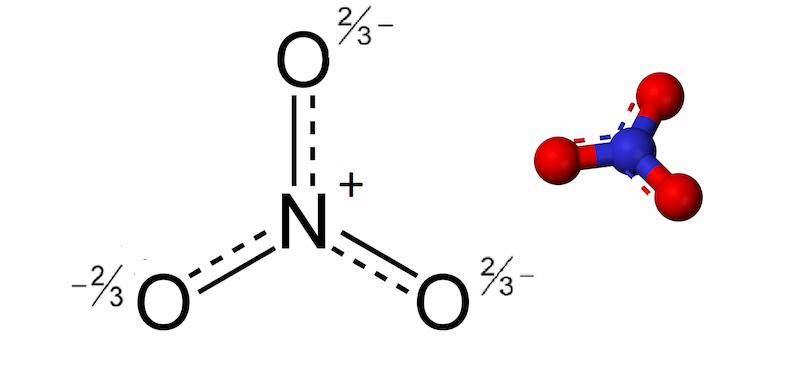
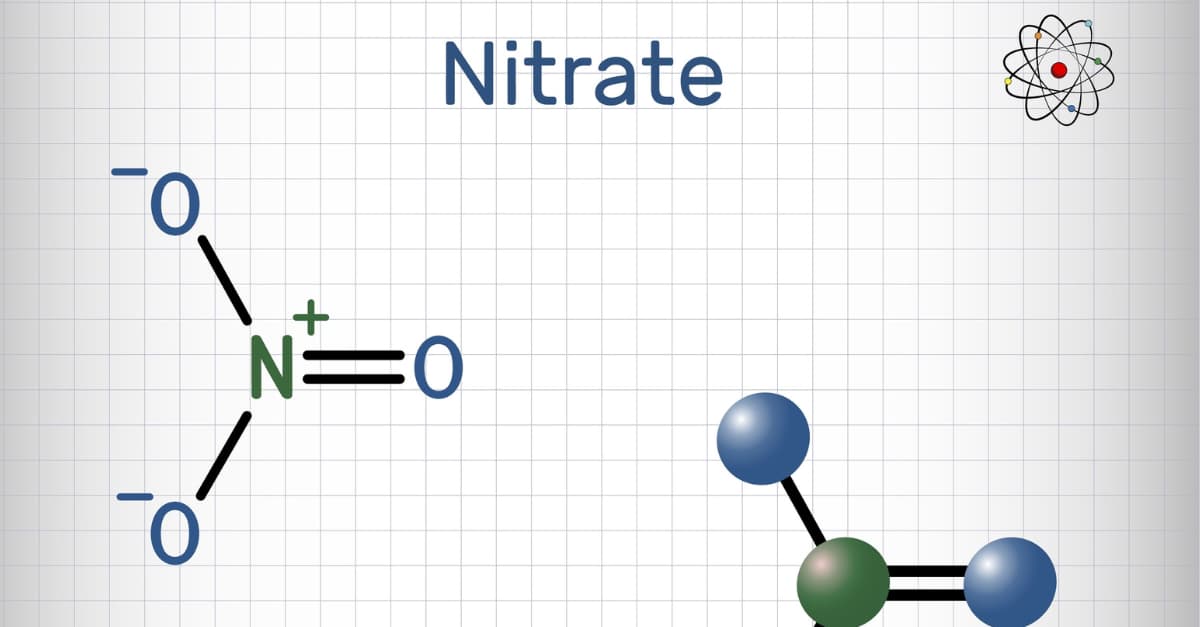
Khái niệm: Muối nitrat là muối của axit nitric. Nó được cấu tạo bởi ion nitrat NO3– cùng các ion kim loại dương. Thông thường, muối nitrat được hình thành nhờ các phản ứng của axit nitric với kim loại. Ngoài ra, nó cũng được tạo ra bởi các ion dương khác như NH4+.
Ví dụ: Thực tế, mỗi loại muối nitrat khác nhau lại sở hữu những tính chất vật lý và tính chất hóa học có phần khác nhau. Một số ví dụ về muối nitrat phổ biến được kể đến như: Natri Nitrat NaNO3, muối Kali Nitrat KNO3, muối amoni nitrat NH4NO3, muối Canxi Nitrat Ca(NO3)2, muối bạc nitrat AgNO3, đồng (II) nitrat (Cu(NO3)2)...
Công thức tổng quát: M(NO3)n.
Tính chất vật lý của muối nitrat
Tất cả các muối nitrat đều tan trong nước dễ dàng và là chất điện li mạnh.
Chúng phân li hoàn toàn thành các ion trong dung dịch loãng:
M(NO3)n → Mn+ + nNO3-
Ví dụ: NaNO3 → Na+ + NO3-
.jpg)
Tính chất hóa học của muối nitrat
Vậy đâu là những tính chất hóa học đặc trưng của muối nitrat mà bạn cần nhớ?

Muối nitrat mang những tính chất hóa học chung của muối
Trước hết, muối nitrat mang những tính chất hóa học chung của muối. Bao gồm:
-
Tác dụng với axit
Muối nitrat tác dụng với axit tạo ra muối mới + axit mới.
Ví dụ: Ba(NO3)2 + H2SO4 → BaSO4 + 2HNO3
-
Tác dụng với bazơ
Muối nitrat tác dụng với dung dịch bazơ, tạo ra muối mới + bazơ mới.
Ví dụ: Mg(NO3)2 + 2NaOH → Mg(OH)2 + 2NaNO3
-
Tác dụng với muối
Muối nitrat tác dụng với dung dịch muối tạo thành 2 muối mới.
Ví dụ: Mg(NO3)2 + Na2CO3 → MgCO3 + 2NaNO3
-
Tác dụng với kim loại
Muối nitrat tác dụng với kim loại có tính khử mạnh hơn kim loại trong muối, tạo ra sản phẩm là muối mới + kim loại mới.
Ví dụ: Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
Sự nhiệt phân của muối nitrat
Muối nitrat dễ bị nhiệt phân hủy và giải phóng oxi. Đây là lý do muối nitrat có tính oxi hóa mạnh ở nhiệt độ cao.
-
Muối nitrat của các kim loại hoạt động mạnh (đứng trước Mg) như kali, natri… sẽ phân hủy tạo ra muối nitrit + O2.
Ví dụ: 2KNO3 → 2KNO2 + O2(↑) (nhiệt độ)
-
Muối nitrat của kim loại trung bình (từ Mg đến Cu) như kẽm, sắt, chì, magie, đồng... bị phân hủy tạo thành oxit của kim loại tương ứng + NO2 và O2.
Ví dụ: 2Cu(NO3)2 --> 2CuO + 4NO2(↑) + O2(↑)
-
Muối nitrat của kim loại đứng sau Cu sẽ bị phân hủy tạo thành kim loại + NO2 + O2
Ví dụ: 2AgNO3 → 2Ag(↓) + 2NO2(↓) + O2(↑) (nhiệt độ)
Chú ý: Trong một số trường hợp, muối nhiệt phân không theo quy luật trên điển hình là Fe(NO3)3, NH4NO3…
Nhận biết muối nitrat như thế nào?
Trong môi trường trung tính, ion NO3- không thể hiện tính oxi hóa. Nhưng ngược lại, trong môi trường axit, ion NO3- thể hiện tính oxi hóa tương đương HNO3.
Như vậy, để nhận biết muối nitrat trong dung dịch, người ta thêm một ít vụn đồng và dung dịch H2SO4 loãng vào hỗn hợp rồi đun nóng nhẹ. Phản ứng tạo ra dung dịch màu xanh, khí NO không màu thoát ra bị oxi hóa thành khí NO màu nâu đỏ.
Phương trình:
3Cu + 8H+ + 2NO3- → 3Cu2+ (dd màu xanh) + 2NO(↑) + 4H20 (ĐK: nhiệt độ)
2NO + O2(không khí) → 2NO2 (màu nâu đỏ)
Điều chế muối nitrat như thế nào?
Muối nitrat được điều chế bằng cách cho HNO3 phản ứng với kim loại, oxit kim loại, bazơ, muối bằng phản ứng trao đổi ion (muối trong đó kim loại giữ nguyên hóa trị) hoặc phản ứng oxi hóa khử (tạo muối kim loại có hóa trị cao).
.jpg)
Ứng dụng quan trọng của muối nitrat
Ứng dụng muối nitrat là gì? Muối nitrat mang nhiều ứng dụng quan trọng trong đời sống thực tiễn. Và, mỗi loại muối khác nhau lại mang những tính chất và ứng dụng riêng.
.jpg)
-
Muối natri nitrat (NaNO3): Được ứng dụng nhiều nhất trong phân bón hóa học (phân đạm) trong nông nghiệp, cùng với NH4NO3, KNO3 và Ca(NO3)2. Bên cạnh đó, nó còn được sử dụng trong chế tạo thuốc súng, dùng để sản xuất axit nitric - một trong những loại hóa chất quan trọng nhất. Ngoài ra, nó còn được sử dụng chung với muối kali nitrat để làm chất bảo quản, ứng dụng trong công nghệ xử lý nước thải...
-
Muối Kali nitrat (KNO3): Ứng dụng nổi bật của Kali nitrat là chế tạo thuốc nổ đen với 75% KNO3, 10% S và 15% C. Muối kali nitrat còn được làm phân bón cho cây trồng, bảo quản thực phẩm, điều chế oxy và axit nitric, sử dụng làm phụ gia trong thực phẩm, kem đánh răng…
-
Muối amoni nitrat (NH4NO3): Được ứng dụng trong sản xuất chất nổ, phân bón, xử lý các quặng titanium, sản xuất N2O, điều chế amoniac khan,…
-
Muối Canxi Nitrat Ca(NO3)2: Nguyên liệu để sản xuất phân bón và sử dụng làm chất phụ gia bê tông trong xây dựng. Sản xuất cao su, ứng dụng trong xử lý nước thải, làm lạnh phòng, tích trữ năng lượng mặt trời… cũng là những ứng dụng nổi bật của Canxi Nitrat.
Xem thêm:
- Khí nitơ (N2): Chi tiết lý thuyết và bài tập áp dụng
- Phản ứng trao đổi ion: Điều kiện xảy ra phản ứng và viết phương trình ion rút gọn
4 dạng muối nitrat phổ biến bạn nên biết
Muối nitrat xuất hiện phổ biến không chỉ trong các dạng bài tập Hóa học THPT mà còn có mặt trong thực tiễn đời sống. Dưới đây là 4 dạng muối nitrat phổ biến nhất mà bạn nên biết.
.jpg)
Muối natri nitrat (NaNO3)
Muối natri nitrat là một trong những loại muối nitrat xuất hiện phổ biến hàng đầu.
Công thức hóa học: NaNO3.
Tính chất vật lý:
-
Dạng tồn tại: Tinh thể hoặc dạng bột trắng. Không có màu và vị hơi ngọt.
-
Tan tốt trong nước và amoniac dạng lỏng, ít tan trong các dung dịch cồn, dễ bị phân hủy.
-
Khối lượng riêng: 2.257 g/cm3.
-
Nhiệt độ nóng chảy: 308 độ C.
-
Nhiệt đội sôi: 380 độ C.
Tính chất hóa học:
-
Dễ bị phân hủy ở nhiệt độ cao. Sản phẩm tạo ra là natri nitrit và oxy.
-
Tác dụng với một số axit. Sản phẩm tạo ra là muối mới + axit mới (trong phản ứng trao đổi), khí và nước (trong phản ứng oxi hóa khử).
Muối kali nitrat (KNO3)
Bên cạnh đó, một trong những muối nitrat khác cũng vô cùng phổ biến chính là Kali nitrat với những tính chất vật lý và hóa học riêng biệt.
Công thức hóa học: KNO3
Tính chất vật lý:
-
Dạng tồn tại: Dạng rắn, màu trắng và không mùi.
-
KNO3 tan nhiều trong nước, it tan trong các dung dịch chứa cồn như ethanol. Khả năng hòa tan tăng tỷ lệ thuận với nhiệt độ nước.
-
Nhiệt độ nóng chảy: 334 độ C
-
Nhiệt độ sôi là 400 độ C.
Tính chất hóa học:
-
KNO3 bị phân hủy tạo ra oxy.
-
Tham gia vào các phản ứng oxi hóa khử
Ví dụ: S + 2KNO3 + 3C → K2S + N2 + 3CO2
-
Trong môi trường axit, KNO3 tác dụng với muối khác
Ví dụ: 6FeSO4 + 2KNO3 (đặc) + 4H2SO4 → K2SO4 + 3Fe2(SO4)3 + 2NO + 4H2O
Amoni nitrat (NH4NO3)
Muối Amoni nitrat là sản phẩm kết hợp của NH3 và axit nitric HNO3. Nó bao gồm các tính chất vật lý và hóa học nổi bật sau:
Công thức hóa học: NH4NO3
Tính chất vật lý:
-
Amoni nitrat NH4NO3 thông thường tồn tại ở dưới dạng tinh thể trong suốt không màu. Tuy nhiên, nó cũng có thể tồn tại dưới dạng chất bột trắng trong điều kiện nhiệt độ phòng và áp suất tiêu chuẩn.
-
Tan hoàn toàn trong nước và dễ bị phân hủy ở nhiệt độ cao.
Tính chất hóa học:
-
Phản ứng nhiệt phân là tính chất hóa học đặc trưng của amoni nitrat. Nó tạo ra các sản phẩm khác nhau tùy theo nhiệt độ.
Ví dụ:
NH4NO3 → NH3 + HNO3 (ở nhiệt độ 110 độ C)
NH4NO3 → N2O + 2H2O (ở nhiệt độ 185 – 200 độ C)
2NH4NO3 → 2N2 + O2 + 4H2O (ở nhiệt độ 230 độ C)
4NH4NO3 → 3N2 + 2NO2 + 8H2O (ở nhiệt độ 400 độ C)
Muối canxi nitrat Ca(NO3)2
Tiếp theo chúng ta cùng tìm hiểu về muối canxi nitrat - một trong những loại muối nitrat điển hình.
Công thức hóa học: Ca(NO3)2
Tính chất vật lý:
-
Muối canxi nitrat là một ợp chất vô cơ không màu, hút ẩm từ không khí.
-
Nhiệt độ nóng chảy: 561 độ C (ở dạng khan) và 42.7 độ C ở dạng ngậm 4 nước.
-
Nhiệt độ sôi: Tự phân hủy (ở dạng khan) và 132 độ C ở dạng ngậm 4 nước.
-
Ca(NO3)2 hòa tan trong amoniac nhưng không hòa tan trong axit nitric; hòa tan trong ethanol tốt hơn metanol.
Tính chất hóa học:
-
Phản ứng phân hủy, tạo ra sản phẩm là canxi nitrit và oxy.
-
Tính oxi hóa mạnh khi tác dụng với phi kim như S, P,…
Bài tập về muối nitrat SGK Hóa học 11 kèm lời giải chi tiết
Như vậy, chúng ta đã tìm hiểu toàn bộ lý thuyết cơ bản xung quanh muối nitrat. Hãy vận dụng kiến thức đã học để thực hành một số bài tập cơ bản về muối nitrat trong SGK 11 sau đây.

Giải bài 4 trang 45 Hóa 11 SGK
a. Trong các phương trình hoá học của phản ứng nhiệt phân sắt (III) nitrat, tổng các hệ số bằng bao nhiêu?
A. 5
B. 7
C. 9
D. 21
b. Trong phương trình hoá học của phản ứng nhiệt phân thuỷ ngân (II) nitrat, tổng các hệ số bằng bao nhiêu?
A. 5
B. 7
C. 9
D. 21
Lời giải:
a. Đáp án D
Phương trình của phản ứng nhiệt phân
4Fe(NO3)3 → 2Fe2O3 + 12NO2 + 3O2 (nhiệt độ)
b. Đáp án A
Phương trình của phản ứng nhiệt phân
Hg(NO3)2 → Hg + 2NO2 ↑ + O2 ↑
Lưu ý: Phản ứng nhiệt phân muối nitrat
-
Muối nitrat của kim loại hoạt động mạnh (K, Na…) bị phân hủy tạo muối nitrit và O2.
-
Muối nitrat của kim loại Mg, Zn, Fe, Cu, Pb…. bị phân hủy tạo oxit kim loại tương ứng, NO2 và O2-.
-
Muối nitrat của Ag, Au, Hg… bị phân hủy tạo thành kim loại tương ứng, NO2 và O2.
Giải bài 5 Hóa 11 SGK trang 45
Viết phương trình hóa học của phản ứng thực hiện dãy chuyển hóa sau:
NO2 (1) → HNO3 (2) → CU(NO3)2
(3) → Cu(OH)2 (4) → Cu(NO3)2
(5) → CuO (6) → Cu (7) → CuCl2
Lời giải:
(1) 4NO2 + O2 + 2H2O → 4HNO3
(2) 8HNO3 + 3Cu → 3Cu(NO3)2 + 2NO↑ + 4H2O
Hoặc CuO + 2HNO3 → Cu(NO3)2 + H2O
(3) Cu(NO3)2 + 2NaOH → Cu(OH)2↓ + 2NaNO3
(4) Cu(OH)2 + 2HNO3 → Cu(NO3)2 + 2H2O
(5) 2Cu(NO3)2 → 2CuO + 4NO2↑ + O2↑
(6) CuO + H2 → Cu + H2O (nhiệt độ)
(7) Cu + Cl2 → CuCl2 (nhiệt độ)
Giải bài 6 Hóa lớp 11 SGK trang 45
Khi hoà tan 30,0g hỗn hợp đồng và đồng (II) oxit trong 1,5 lít dung dịch axit nitric 1,00M (loãng) thấy thoát ra 6,72 lít nitơ monooxit (đktc). Xác định hàm lượng phần trăm của đồng (II) oxit trong hỗn hợp, nồng độ mol của đồng (II) nitrat và axit nitric trong dung dịch sau phản ứng, biết rằng thể tích các dung dịch không thay đổi.
Lời giải:
n(HNO3) = 1.5. 1.00 = 1.50 (mol)
n(NO) = 6.72/ 22.4 = 0,3(mol)
PTHH:
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O (1)
CuO + 2HNO3 → Cu(NO3)2 + H2O (2)
Theo phương trình (1), n(Cu) = 3/2 x n(NO) = 3/2 x 0.3 = 0.45 mol
Gọi n(CuO) = y mol
Ta có: m(hỗn hợp) = m(Cu) + m(CuO) = 0.45 x 64 + 80y = 30,00
⇒ y = 0,015 ⇒ n(CuO) = 0.015 mol ⇒ m(CuO) = 0.015. 80 = 1.2g
(Hoặc m(CuO) = 30 - 0.45 x 64 = 1.2g)
%CuO = 1.2/30 x 100% = 4%
Theo pt (1), n Cu(NO3)2 = nCu = 0.45 mol
Theo pt (2), n Cu(NO3)2 = n(CuO) = 0.015 mol
⇒ Tổng nCu(NO3)2 = 0.45 + 0.015 = 0.465 mol
CM(Cu(NO3)2 = 0.465/ 1.5 = 0.31 (M)
Theo pt(1) n(HNO3) = 4 x n(NO) = 4 x 0.3 = 1.2 mol
Theo pt(2) n(HNO3) = 2 x n(CuO) = 2 x 0.015 = 0.03 mol
n(HNO3) dư = 1.5 - 1.2 - 0.03 = 0.27 mol
CM HNO3 = 0.27/ 1.5 = 0.18 (M)
Hy vọng qua những kiến thức trên, bạn đọc đã hiểu rõ muối nitrat là gì, ứng dụng muối nitrat và thành thạo các dạng bài tập muối nitrat từ cơ bản đến nâng cao. Đừng quên truy cập Monkey mỗi ngày để không bỏ lỡ những bài học thú vị khác về môn Toán, Lý và Hóa học nhé! Chúc bạn có một quá trình học tập hiệu quả.
Nitrate Salts - Ngày truy cập: 21/7/2022
https://www.alfa.com/en/nitrate-salts/
Sodium nitrate - Ngày truy cập: 21/7/2022
https://en.wikipedia.org/wiki/Sodium_nitrate






.png)
.png)






.png)