Benzen (C6H6) được biết là một hiđrocacbon thơm với nhiều ứng dụng trong công nghiệp và đời sống. Không những vậy, Benzen còn là một dung môi hữu cơ được sử dụng khá phổ biến. Nó có cấu trúc khác với metan, etylen hoặc axetylen. Vậy cấu tạo phân tử của benzen là gì? Những tính chất vật lý và hóa học của benzen là gì? Chúng ta sẽ cùng nhau tìm hiểu chúng trong bài viết hôm nay nhé!
.png)
Khái niệm benzen là gì?
Benzen là một hydrocacbon thơm ít tan trong nước nhưng dễ tan trong dầu khoáng, dầu động thực vật, dung môi hữu cơ,… đặc biệt là chất béo, sơn, vecni, hắc ín, cao su và nhựa đường, nhựa than,…
Trong công nghiệp, benzen là nguyên liệu dùng để tổng hợp nhiều hợp chất hữu cơ như anilin, clo benzen, nitrobenzen, phenol,… dùng làm dung môi hòa tan các chất béo.
Kể từ những năm 1970, benzen đã bị hạn chế sử dụng trong công nghiệp. Tại Việt Nam, việc cấm sử dụng hóa chất benzen trong công nghiệp đã được quy định tại số 108 LB/QĐ.
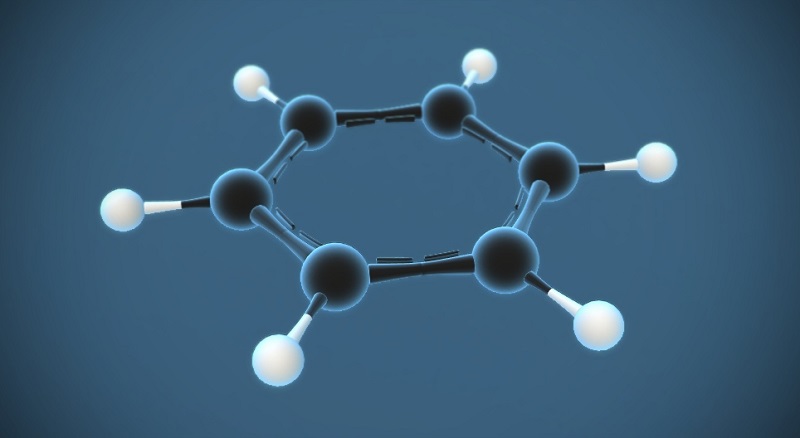
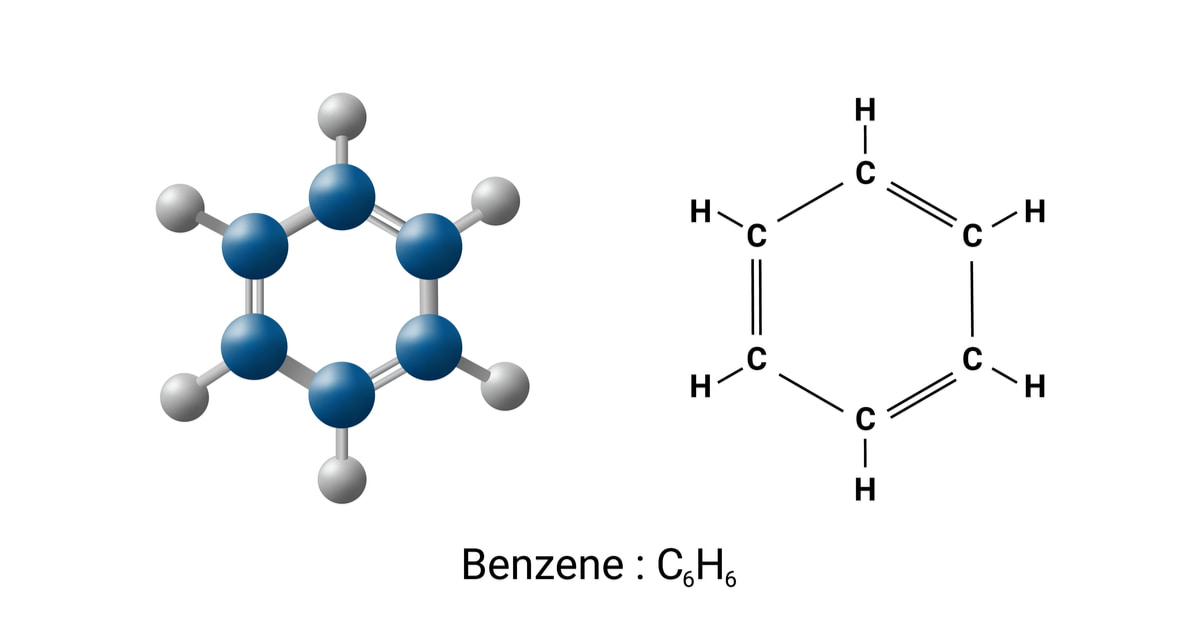
Công thức phân tử của benzen là: C6H6.
- Phân tử khối: 78
- Cấu tạo phân tử:
.jpg)
Công thức tổng quát của benzen
Nhìn chung, Benzen có công thức phân tử là C6H6. Công thức tổng quát của benzen và đồng đẳng của nó là CnH2n-6 (n ≥ 6).
Cấu tạo phân tử của benzen
Benzen là một hiđrocacbon thơm có cấu tạo gồm 6 nguyên tử carbon liên kết với nhau tạo thành một vòng phẳng. Mỗi nguyên tử carbon trong vòng benzen liên kết với một nguyên tử hydro. Các liên kết trong cấu tạo vòng benzen đều là liên kết cộng hóa trị. Đồng thời, vòng benzen có cấu tạo đối xứng.
Benzen và đồng đẳng
Benzen là hiđrocacbon thơm đơn giản nhất. Đồng đẳng của benzen là những hiđrocacbon thơm có cấu tạo tương tự như benzen nhưng có nhiều hơn 6 nguyên tử carbon. Ví dụ: Toluen (C7H8), Etylbenzen (C8H10), Xilen (C8H10),...
Cách gọi tên (danh pháp) đồng đẳng, đồng phân của benzen
1. Đối với đồng đẳng của benzen: Gọi tên theo tên gốc ankyl + benzen.
Ví dụ:
- C6H5CH3: Etylbenzen
- C6H5CH2CH3: n-Propylbenzen
- C6H5CH(CH3)2: isopropylbenzen
2. Gọi tên đồng phân của benzen: Dựa vào vị trí của các nhóm thế trên vòng benzen, ta có các tiền tố:
- o-: ortho (1,2)
- m-: meta (1,3)
- p-: para (1,4)
Ví dụ: C6H4(CH3)2: Xilen
- o-Xilen (1,2-đimetylbenzen)
- m-Xilen (1,3-đimetylbenzen)
- p-Xilen (1,4-đimetylbenzen)
Để làm bài tập tốt hơn thì chỉ biết về cấu tạo benzen là chưa đủ, bạn cần biết thêm về tính chất của benzen từ vật lý đến hóa học.
Tính chất vật lý của benzen
Benzen (C6H6) là chất lỏng không màu, nhẹ hơn nước và không tan trong nước. Benzen có thể hòa tan nhiều chất như: Dầu ăn, cao su, nến, iot... và nhiều dung môi hữu cơ khác. Benzen là chất độc và dễ cháy.
C6H6 có khối lượng riêng 0,8786 g/cm3 chất lỏng, nóng chảy ở 5,5 độ C, sôi ở 80,1 độ C.
Tính chất hóa học của benzen
Tính chất của Benzen có các phản ứng hóa học đặc trưng như cháy, thế và cộng. C6H6 vừa có phản ứng thế vừa có phản ứng cộng, nhưng phản ứng cộng xảy ra khó hơn so với C2H4 và C2H2.

Benzen dễ cháy
Giống như các hydrocacbon khác, benzen cháy trong oxy để tạo ra CO2 và hơi nước. Tuy nhiên, khi benzen cháy trong không khí, ngoài CO2 và hơi nước còn tạo ra muội than.
2C6H6 + 15O2 (nhiệt độ) → 12CO2 + 6H2O
Phản ứng thế của benzen với brom (phản ứng thế)
Đặc điểm cấu tạo của benzen: Khi đun nóng hỗn hợp benzen với brom, có mặt bột sắt thấy màu nâu đỏ của brom bị mất đi và có khí hidro bromua bay ra.
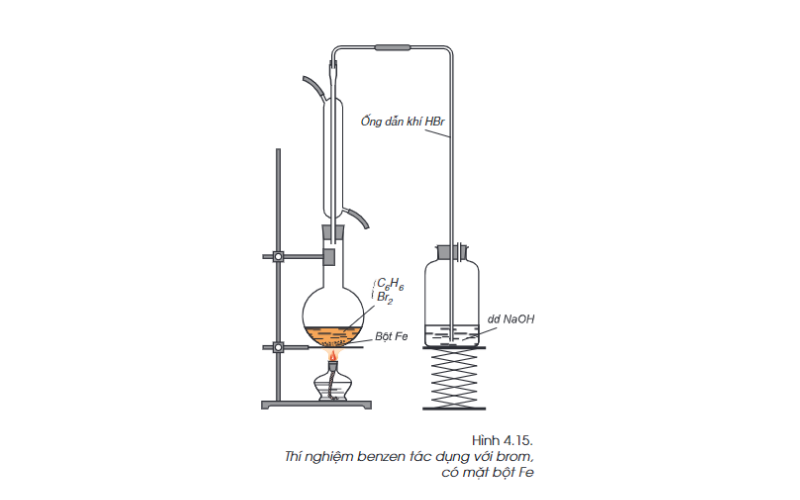
C6H6(l) + Br2(l) (t, bột Fe) → C6H5Br (chất lỏng không màu) + HBr(k)
Trong phản ứng trên, nguyên tử hidro trong phân tử benzen được thay thế bởi nguyên tử brom.
Phản ứng cộng của benzen
Benzen không phản ứng với dung dịch Br2, chứng tỏ benzen khó tham gia phản ứng cộng như C2H4 và C2H2. Tuy nhiên ở nhiệt độ và điều kiện xúc tác thích hợp, C6H6 tham gia phản ứng cộng với một số chất, ví dụ như H2, ...
C6H6 + 3H2 (t, Ni) → C6H12
Điều chế benzen như thế nào?
Trong đời sống, benzen được sử dụng rất nhiều trong sản xuất dược phẩm hay các chất quan trọng phục vụ nhu cầu của con người. Vậy benzen được điều chế như thế nào? Hãy tham khảo ngay nội dùng sau đây:
-
Điều chế benzen từ axetilen
Phản ứng trùng hợp axetilen xảy ra khi xúc tác là C và nung ở nhiệt độ 600 độ C.
3CH = CH → C6H6
-
Điều chế benzen từ axit benzoic
C6H5COOH + NaOH → C6H6 + Na2CO3
-
Điều chế benzen từ chưng cất nhựa than đá
-
Điều chế từ xiclohexan sử dụng xúc tác Pt và đun nóng
C6H12 → C6H6 + 3H2
-
Điều chế từ n - hexan xúc tác và đun nóng
C6H14 → C6H6 + 4H2
Xem thêm:
- Hợp chất hữu cơ là gì? Khái niệm về hợp chất hữu cơ và hóa học hữu cơ
- Khí metan là gì? Trạng thái tự nhiên, tính chất, ứng dụng và cách điều chế
Các ứng dụng của benzen
Trong công nghiệp, benzen được sử dụng trong một số ngành công nghiệp hóa hữu cơ. Bên cạnh đó, chúng còn được sử dụng để tổng hợp monome trong sản xuất polyme dùng cho nhựa, cao su và sợi.
.jpg)
Benzen cũng thường được dùng để làm dung môi hòa tan các chất như dầu mỡ, cao su, vecni. Dùng để tẩy dầu mỡ cho xương, sợi, vải, len, dạ, giặt khô, tẩy dầu mỡ cho tấm kim loại. Ngoài ra, những dụng cụ có vết dầu mỡ thường dùng benzen để làm sạch.
Benzen còn được dùng để chế tạo các chất trong sản xuất như nitrobenzene, anilin, phenol, tổng hợp thuốc nhuộm, dược phẩm, thuốc trừ sâu, sản xuất cumene, axeton và phenol.

Monkey Math - Ứng dụng học toán tiếng Anh chỉ với 2K/Ngày

Phenol: Cấu tạo, tính chất, cách điều chế và những ứng dụng phổ biến

Dung môi là gì? Tổng quan kiến thức về dung môi và ví dụ minh họa
Benzen độc không? Ảnh hưởng đến sức khỏe con người như thế nào?
Ngoài những tác dụng vô cùng lớn ở trên, benzen còn được biết đến là một chất cực độc đối với sức khỏe và khả năng gây ung thư của chúng là rất cao. Những người bị ngộ độc benzen cấp tính sẽ gặp các triệu chứng sau:
.jpg)
-
Nhức đầu, chóng mặt, buồn nôn, lú lẫn.
-
Mất ý thức, hôn mê, giảm trí nhớ.
-
Giảm thính lực.
-
Viêm phổi.
-
Bỏng, viêm kết mạc, giác mạc, mù màu.
-
Viêm gan nhiễm độc.
-
Viêm cầu thận.
-
Tổn thương tim mạch
Khi bị nhiễm độc mãn tính sẽ có 2 giai đoạn chính. Đó là:
-
Giai đoạn khởi phát khiến chúng ta bị: rối loạn tiêu hóa, rối loạn thần kinh, rối loạn huyết học.
-
Trong thời kỳ toàn phát sẽ xuất hiện các triệu chứng như chảy máu, thiếu máu, giảm bạch cầu,…
Chúng ta có thể bị nhiễm độc benzen thông qua các đường sau:
-
Trong thực phẩm, benzen được dùng để bảo quản thực phẩm, đặc biệt là nước ngọt đóng chai.
-
Benzen có trong không khí khi chúng ta sử dụng để sản xuất công nghiệp lúc đó khí sẽ bay hơi. Hoặc trong chất thải của phương tiện giao thông sử dụng nhiên liệu hóa thạch.
Đối với những người lao động khai thác dầu mỏ, người lao động sản xuất đồ nhựa, công nhân sản xuất và chế biến đồ nhựa,... để đảm bảo sức khỏe, bạn nên thăm khám bác sĩ thường xuyên, định kỳ 6 tháng nên tổ chức kiểm tra một lần. Nếu phát hiện dù chỉ một trường hợp ngộ độc thì phải tổ chức khám tất cả những công nhân bị phơi nhiễm. Về các hiện tượng lâm sàng, chú ý tình trạng toàn thân: Cân nặng, ăn uống, ngủ nghỉ… Ngoài ra, cần phát hiện dấu hiệu xuất huyết.
[FAQ] Những câu hỏi khác về Benzen
1. Chất benzen có ở đâu?
Benzen là một hợp chất hóa học thường có trong dầu mỏ, than đá và cũng được tạo ra trong nhiều ngành công nghiệp, đặc biệt là trong sản xuất nhựa, sơn, thuốc nhuộm và các loại chất tẩy rửa.
2. Dẫn xuất của benzen là gì?
Phenol là một ví dụ điển hình của dẫn xuất benzen. Nó được tạo thành khi một trong các nguyên tử hydro trong vòng benzen được thay thế bằng nhóm hydroxyl (hay còn gọi là nhóm rượu, có công thức -OH).
3. Vòng benzen có tính chất gì?
Mặc dù có độ bất bão hòa rất lớn, vòng benzen lại rất khó tham gia phản ứng cộng và khó bị oxi hóa. Thay vào đó, nó lại dễ dàng tham gia phản ứng thế (giống như các hydrocarbon no).
Điểm đáng chú ý khác là tính bền vững vượt trội của vòng benzen. Nó ổn định hơn nhiều so với ước tính từ cấu trúc cyclohexatriene, với mức năng lượng chênh lệch khoảng 150 kJ/mol. Sự ổn định đặc biệt này chính là nhờ năng lượng thơm hóa (aromaticity) của vòng benzen.
4. Xăng benzen là gì?
Benzen là một chất lỏng không màu, dễ cháy, có mùi ngọt đặc trưng và là một trong những thành phần tạo nên mùi của xăng. Hợp chất này được sử dụng chủ yếu làm tiền chất để sản xuất các hóa chất có cấu trúc phức tạp hơn, chẳng hạn như etylbenzen và cumen, với sản lượng hàng tỷ kilogam mỗi năm trên toàn cầu.
Bài tập về benzen SGK Hóa học 9 kèm lời giải
Dựa vào những kiến thức trên bạn có thể tận dụng để giải một số bài tập trong SGK Hóa học lớp 9:

Bài tập 1 (Trang 125 SGK Hóa học 9)
Cấu tạo đặc biệt của phân tử benzen là:
a) Phân tử có 6 vòng cạnh.
b) Phân tử có ba liên kết đôi.
c) Phân tử có 6 vòng cạnh chứa ba liên kết đôi xen kẽ ba liên kết đơn.
d) Phân tử có 6 vòng cạnh chứa ba liên kết đôi và ba liên kết đơn.
Hãy chọn câu đúng nhất trong các câu trên.
Gợi ý đáp án:
Chọn câu c) đúng.
Bài tập 2 (Trang 125 SGK)
Một số học sinh viết công thức cấu tạo của benzen như sau:
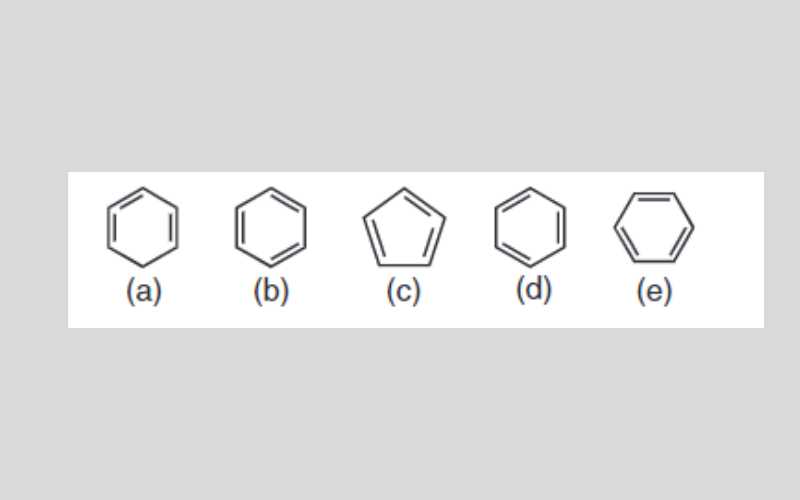
Hãy cho biết công thức nào viết đúng, viết sai, tại sao?
Gợi ý đáp án:
Công thức cấu tạo đúng của benzen: b), d), e)
(a) sai vì 2 liên kết Pi ở 2 nguyên tử C liền kề nhau (sai về vị trí liên kết đôi)
(c) sai vì có 5 nguyên tử C
Bài tập 3 (Trang 125 SGK)
Cho benzen tác dụng với brom tạo ra brombenzen:
a) Viết phương trình hóa học (có ghi rõ điều kiện phản ứng).
b) Tính khối lượng benzen cần dùng để điều chế 15,7g brombenzen. Biết hiệu suất phản ứng đạt 80%.
Gợi ý đáp án:
a) Phương trình phản ứng:
C6H6 + Br2 (Fe)→ C6H5Br + HBr.
b) nC6H5Br = 15,7 / 157 = 0,1 mol.
Theo phương trình: nC6H6 = nC6H5Br = 0,1 mol.
Do H = 80% nên:
mC6H6 = 0,1. 78 : 80% = 9,75(g)
Bài tập 4 (Trang 125 SGK)
Hãy cho biết chất nào trong các chất sau đây có thể làm mất màu dung dịch brom. Giải thích và viết phương trình hóa học (nếu có).
a) C6H6.
b) CH2 = CH – CH = CH2.
c) CH3 – C≡ CH.
d) CH3 – CH3.
Gợi ý đáp án:
Chỉ có chất b) và c) làm mất màu dung dịch brom. Vì trong phân tử có liên kết đôi và liên kết ba tương tự như C2H4 và C2H2.
b) CH2 = CH – CH = CH2 + 2Br2 (dd)→ CH2Br – CHBr – CHBr – CH2Br.
Hoặc: CH2 = CH – CH = CH2 + Br2 → CH2Br – CHBr – CH = CH2
c) CH3 – C ≡ CH + 2Br2 → CH3 – CBr2 – CHBr2
Hoặc CH3 – C ≡ CH + Br2 → CH3 – CBr = CHBr
Bài tập về Benzen hóa học để học sinh tự luyện
Bài 1: Chất nào sau đây có khả năng tham gia phản ứng trùng hợp tạp polime?
A. benzen B. toluen C. 3 propan D. stiren
Bài 2: Chất nào sau đây làm mất màu dung dịch KMnO4 ở nhiệt độ thường?
A. benzen B. toluen C. propan D. stiren
Bài 3: Benzen tác dụng với Br2 theo tỷ lệ mol 1 : 1 (có mặt bột Fe), thu được sẩn phẩm hữu cơ là
A.C6H6Br2 B. C6H6Br6
C. C6H5Br D. C6H6Br4
Bài 4: Benzen tác dụng với H2 dư có mặt bột Ni xúc tác, thu được
A. hex-1-en B. hexan
C. 3 hex-1-in D. Xiclohexan
Bài 5: Phản ứng Benzen tác dụng với clo tạo C6H6Cl6 xảy ra trong điều kiện:
A. Có bột Fe xúc tác B. Có ánh sánh khuyếch tán
C. Có dung môi nước D. Có dung môi CCl4
Bài 6: Dãy gồm các nhóm thế làm cho phản ứng thế vào vòng benzen dễ dàng hơn và ưu tiên vị trí m- là:
A. -CnH2n+1, -OH, -NH2 B. –OCH3, -NH2, -NO2
C. –CH3, -NH2, -COOH D. –NO2, -COOH, -SO3H
Bài 7: Phản ứng nào sau đây không xảy ra:
A. Benzen + Cl2 (as) B.Benzen + H2 (Ni, tº)
C. Benzen + Br2 (dd) D.Benzen + HNO3 /H2SO4(đ)
Bài 8: Cho benzen + Cl2 (as) ta thu được dẫn xuất clo A. Vậy A là:
A.C6H5Cl B.p-C6H4Cl2 C.C6H6Cl6 D.m-C6H4Cl2
Bài 9: Cho benzen tác dụng với lượng dư HNO3 đặc có xúc tác H2SO4 đặc để điều chế nitrobenzen. Khối lượng Nitrobenzen điều chế được từ 19,5 tấn benzen (hiệu suất phản ứng 80%) là bao nhiêu?
Bài 10: Chất X là đồng đẳng của benzen, có công thức đơn giản nhất là C3H8 .Công thức phân tử của của X là gì?
Bài 11: Đốt cháy hoàn toàn ankybenzen X thu được 7,84 lít CO2 (đktc) và 3,6 gam H2O. Công thức phân tử của X là bao nhiêu?
Trên đây Monkey đã giới thiệu với các bạn về tính chất vật lý, tính chất hóa học, cấu tạo phân tử của Benzen C6H6. Hy vọng bài viết này sẽ giúp bạn hiểu rõ hơn. Nếu bạn cần tìm hiểu thêm về nhiều môn học khác có thể truy cập vào website để có thêm nhiều kiến thức thú vị nhé!









.png)
.png)






.png)