Mol, Khối lượng Mol và Thể tích Mol của chất khí là những kiến thức nền tảng và quan trọng trong chương trình Hóa học lớp 8 của Bộ Giáo dục & Đào tạo.
Bài viết này của Monkey cung cấp một tổng hợp chi tiết và trực quan nhằm giúp học sinh hiểu rõ và nắm vững các khái niệm sau:
-
Mol là gì?
-
Khối lượng Mol (M) là gì?
-
Cách tính Thể tích Mol của chất khí (Vmol) như thế nào?
Cùng Monkey khám phá ngay để làm chủ bài học này!
.png)
Video bài giảng được tạo bởi notebooklm.google.com
Mol là gì?
Nguyên tử và phân tử có kích thước, khối lượng rất nhỏ nên chúng ta không thể đo đếm trực tiếp. Tuy nhiên, trong Hóa học, việc biết chính xác số lượng nguyên tử, phân tử cũng như khối lượng, thể tích của chúng trong phản ứng là rất quan trọng.
Để giải quyết vấn đề này, các nhà khoa học đã đưa ra khái niệm Mol - dùng để đo lượng các hạt vi mô (nguyên tử, phân tử).
Theo SGK Hóa học 8 (trang 63):
“Mol là lượng chất có chứa 6.10²³ nguyên tử hoặc phân tử của chất đó.”
Con số 6.10²³ được gọi là số Avogadro, ký hiệu là N.
Phân loại:
- Mol nguyên tử: Lượng chất chứa N nguyên tử.
- Mol phân tử: Lượng chất chứa N phân tử.
Đơn vị đo:
- Trong Hóa học: g/mol
- Trong Vật lý: kg/mol (vì SI dùng đơn vị kilôgam)
Ví dụ:
- 1 mol nguyên tử nhôm chứa N nguyên tử Al.
- 1 mol phân tử nước chứa N phân tử H₂O.
.jpg)
Khối lượng Mol là gì? Cách tính khối lượng Mol
Theo SGK Hóa học 8 (trang 63):
“Khối lượng mol (ký hiệu M) của một chất là khối lượng, tính bằng gam, của N nguyên tử hoặc N phân tử chất đó.”
Nói cách khác, khối lượng mol cho biết 1 mol chất nặng bao nhiêu gam.
Giá trị M của một chất bằng đúng số trị của nguyên tử khối hoặc phân tử khối, nhưng có đơn vị là g/mol.
Ví dụ:
- Khối lượng mol nguyên tử hiđro: M_H = 1 g/mol
- Khối lượng mol phân tử oxi: M_O₂ = 32 g/mol
Cách tính khối lượng mol nguyên tử:
- Tìm nguyên tử khối của từng nguyên tố trong bảng tuần hoàn.
- Nhân nguyên tử khối với số nguyên tử của nguyên tố đó trong phân tử.
- Cộng tất cả lại để ra khối lượng mol của chất.
Công thức tổng quát:
- Ai : Nguyên tử khối của nguyên tố i
- ni : Số nguyên tử của nguyên tố i trong phân tử
Ví dụ: Khối lượng mol của H₂O = (1 × 2) + 16 = 18 g/mol.
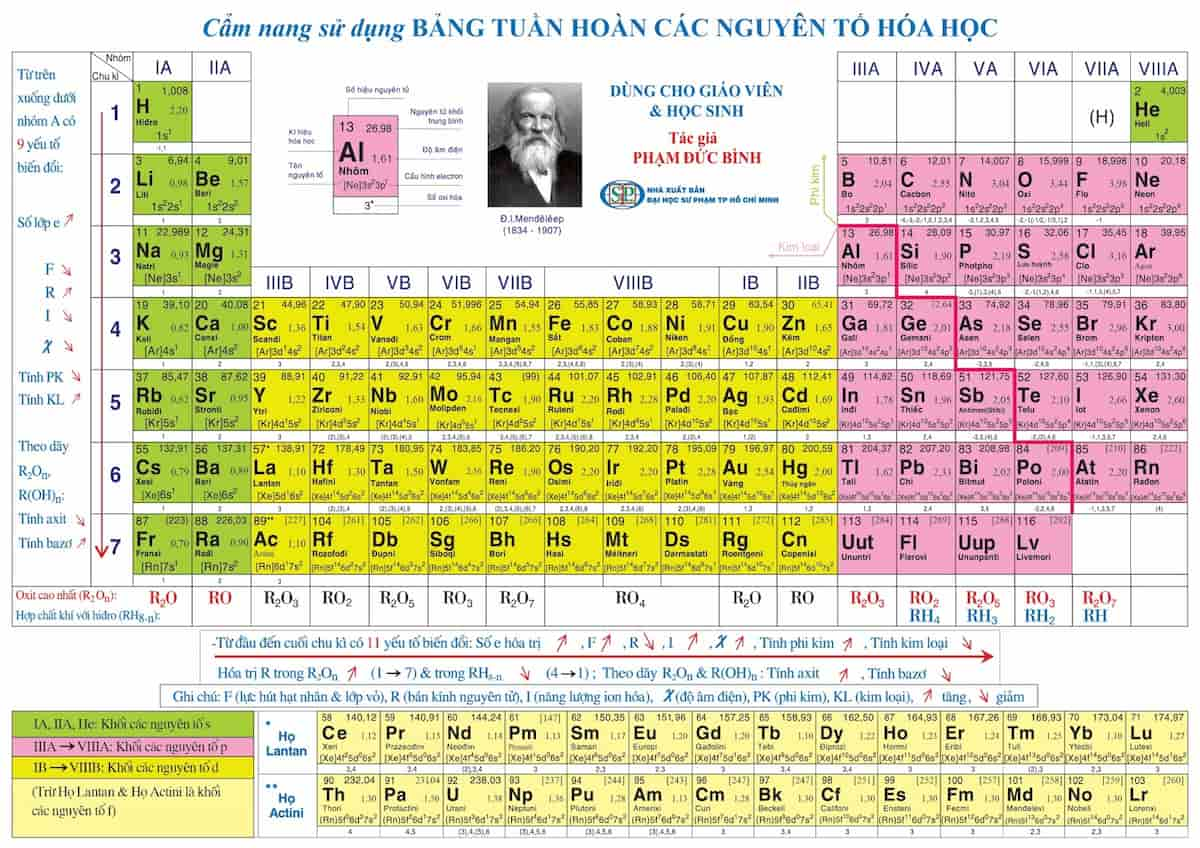
Bảng tuần hoàn hóa học lớp 7 8 9 10 đầy đủ chi tiết nhất
Andehit là gì? Đặc điểm cấu tạo, tính chất, cách điều chế và ứng dụng

Ancol: Đầy đủ lý thuyết và giải bài tập chi tiết
Thể tích Mol gì? Cách tính thể tích Mol
Theo SGK Hóa học 8, thể tích mol của chất khí là thể tích chiếm bởi N phân tử (1 mol) của chất khí đó.
Nói cách khác, 1 mol chất khí sẽ chiếm một thể tích nhất định trong điều kiện nhiệt độ và áp suất xác định.
Đặc điểm quan trọng:
- Ở cùng điều kiện nhiệt độ và áp suất, 1 mol của mọi chất khí đều có thể tích bằng nhau.
- Ở điều kiện tiêu chuẩn (0°C và 1 atm), thể tích mol của chất khí là 22,4 lít/mol.
Ví dụ:
- Khối lượng mol của H₂ là 2 g/mol.
- Khối lượng mol của CO₂ là 44 g/mol.
Dù khác khối lượng, nhưng ở điều kiện tiêu chuẩn, cả hai khí đều chiếm thể tích 22,4 lít.
Cách tính thể tích mol của chất khí:
V = n x 22,4
Trong đó:
- V: Thể tích chất khí (lít)
- n: Số mol chất khí
- 22,4 lít/mol: Thể tích của 1 mol chất khí ở điều kiện tiêu chuẩn (đktc).\
Ví dụ: Nếu có 0,5 mol O₂, thì thể tích là: V = 0,5 x 22,4 = 11,2 lít
Nồng độ mol là gì?
Nồng độ mol (hay nồng độ mol/lít) cho biết số mol chất tan có trong 1 lít dung dịch.
Công thức:
C = n / V
Trong đó:
- C: Nồng độ mol (mol/L)
- n: Số mol chất tan
- V: Thể tích dung dịch (lít)
Đơn vị:
- Đơn vị SI là mol/m³.
- Thường dùng trong Hóa học: mol/L, mol/dm³ hoặc viết tắt là M.
Các đơn vị nhỏ hơn thường gặp:
- mmol/L hoặc mM: milimol trên lít
- µmol/L hoặc µM: micromol trên lít
- nmol/L hoặc nM: nanomol trên lít
Muốn con học tốt Hóa học sau này, điều quan trọng là xây dựng nền tảng tư duy logic và ngôn ngữ vững chắc ngay từ nhỏ. Các ứng dụng học tập của Monkey giúp trẻ phát triển khả năng đọc hiểu, ghi nhớ và tư duy khoa học qua hàng ngàn bài học tương tác sinh động.
Bắt đầu cùng Monkey hôm nay để con học thông minh - tư duy tự tin - sẵn sàng chinh phục mọi môn học!
![]() Bài tập thực hành củng cố kiến thức Mol (Tải file PDF Free)
Bài tập thực hành củng cố kiến thức Mol (Tải file PDF Free)
>>> Tải ngay: Bộ đề Chuyên đề Mol và tỉ khối chất khí bồi dưỡng HSG Hóa 8 có lời giải
Bài số 1: Số Avogadro và ký hiệu là gì?
A. 6.1023, A
B. 6.1023, A
C. 6.1023, N
D. 6.1024, N
Đáp án đúng: 6.1023, N
Bài số 2: Tìm khối lượng của 1 mol nguyên tử Cu và 1 mol phân tử CuO
Đáp án: MCu = 64g ; MCUO = (64 + 16)g = 80g.
Bài tập 3: Khối lượng mol của sắt là 56 g/mol. Tính số nguyên tử Fe trong 1 mol Fe.
Đáp án: 6,022.10^23 nguyên tử Fe
Bài tập 4: Theo phương trình hóa học sau: 2H2 + O2 → 2H2O. Tính số mol khí hydro cần dùng để phản ứng hoàn toàn với 2 mol khí oxi.
Đáp án: 2 mol
Bài tập 5: Tính thể tích của 1 mol khí oxi ở điều kiện tiêu chuẩn.
Đáp án: 22,4 lít
Xem thêm: Định luật bảo toàn khối lượng - Khái niệm, nội dung và áp dụng

[FAQ] - Những thắc mắc khác về Mol
1. Số mol là gì?
Số mol cho biết lượng chất chứa bao nhiêu hạt (nguyên tử, phân tử, ion), ký hiệu là n.
2. 1 mol bằng bao nhiêu lít?
Ở điều kiện tiêu chuẩn (0°C, 1 atm), 1 mol chất khí = 22,4 lít.
3. Đơn vị mol là gì?
Đơn vị của mol là mol - đơn vị đo lượng chất trong Hóa học.
4. Khối lượng mol của oxi là bao nhiêu?
Khối lượng mol của oxi (O₂) là 32 g/mol.
5. Khối lượng mol của hidro là bao nhiêu?
Khối lượng mol của hiđro (H₂) là 2 g/mol.
6. Khối lượng mol kí hiệu là gì?
Khối lượng mol được ký hiệu là M.
7. M lớn trong hóa học là gì?
M là ký hiệu của khối lượng mol - khối lượng của 1 mol chất (tính bằng g/mol).
Vậy là chúng ta đã tìm hiểu về chuyên đề số mol là gì? Khối lượng mol là gì? Cách tính khối lượng mol chất. Các bạn hãy theo dõi Monkey thường xuyên để cập nhật những kiến thức Hóa học và các môn học khác thường xuyên nhé.
1. SGK Hóa học 8 (chương trình cũ), trang 63 - Tham khảo ngày 28/10/25.
2. Amount of Substance (the mole, mol) - Tham khảo ngày 28/10/25.
https://www.itc.gov.hk/en/quality/scl/teachers_students/si/mole.html
3. Mole - Tham khảo ngày 28/10/25.
https://www.britannica.com/science/mole-chemistry










.png)
.png)







.png)