Liên kết cộng hóa trị là một liên kết hóa học cơ bản thường gặp. Đây là một trong những kiến thức quan trọng trong chương trình Hóa học Trung học phổ thông. Vậy liên kết này là gì? Bài viết của Monkey sau đây sẽ giúp bạn có thêm các thông tin chi tiết về khái niệm, phân loại tính chất cùng một số bài tập thực hành trong SGK Hóa 10.
.png)
Liên kết cộng hóa trị là gì?
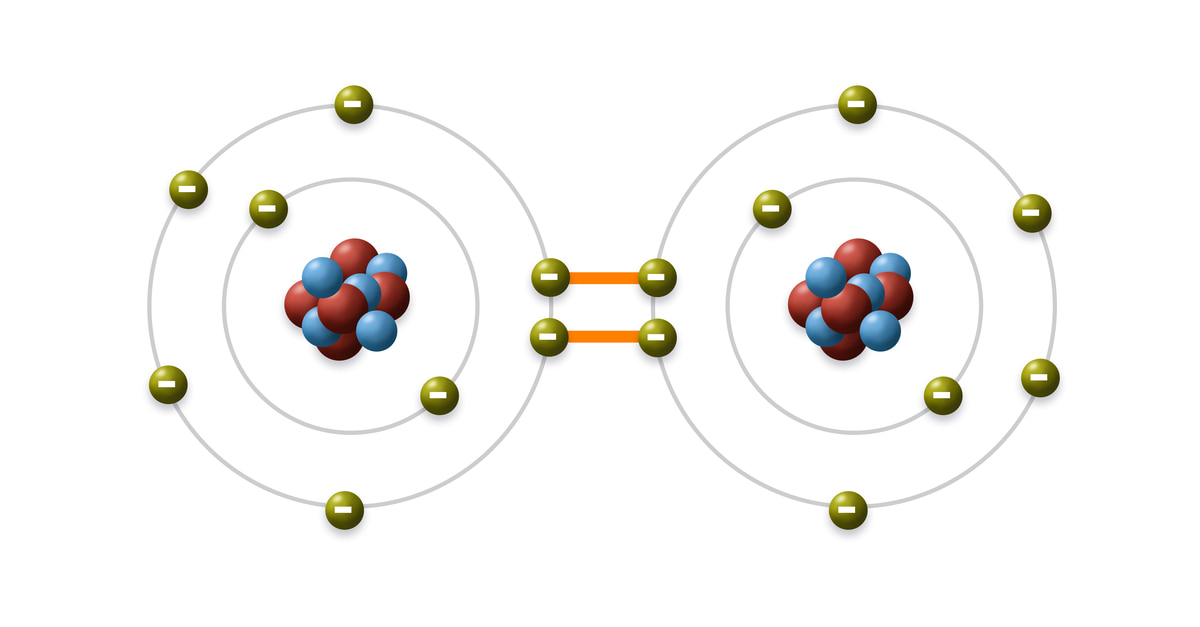
Liên kết cộng hóa trị thường được hình thành giữa 2 nguyên tử bằng một hay nhiều cặp electron dùng chung. (Viết tắt: LKCHT).
Nói cách khác, liên kết này được hiểu là liên kết giữa hai nguyên tử hay ion trong đó các cặp electron sẽ được chia sẻ với nhau. Mỗi cặp electron được chia sẻ giữa hai nguyên tử được gọi là cặp liên kết, ngược lại nếu không được chia sẻ sẽ được gọi là cặp đơn độc. Với nhiều phân tử, việc dùng chung electron khiến cho mỗi nguyên tử đạt được cấu hình electron bền vững.
Liên kết hóa trị hình thành giữa các nguyên tử giống nhau – Sự hình thành đơn chất
Trong phần này, chúng ta cùng tìm hiểu sự liên kết hóa trị hình thành giữa các nguyên tử giống nhau thông qua sự hình thành của Hidro (H2) và Nitơ (N2).
Sự hình thành phân tử Hidro (H2)
Nguyên tử H (Z = 1) có cấu hình electron là ls1. Trong đó, hai nguyên tử H liên kết với nhau bằng cách mỗi nguyên tử H góp 1 electron tạo thành một cặp e chung. Như vậy, trong phân tử H2, mỗi nguyên tử H có 2 electron, giống cấu hình electron bền vững của khí hiếm heli:
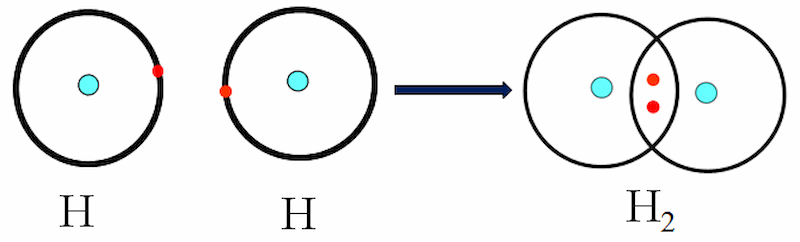
Mỗi chấm bên kí hiệu nguyên tố biểu diễn một e lớp ngoài cùng.
-
Công thức electron: H: H
-
Công thức cấu tạo: H-H. Giữa 2 nguyên tử H có 1 cặp electron liên kết biểu thị bằng một gạch (-).
-
Đây là liên kết đơn.
Sự hình thành phân tử Nitơ (N2)
Nguyên tử N (Z = 7) có cấu hình electron là: 1s22s22p với 5 electron ở lớp ngoài cùng.
Trong phân tử nitơ N, mỗi nguyên tử phải góp chung 3 electron để đạt cấu hình electron của nguyên tử khí hiếm gần nhất là Ne.
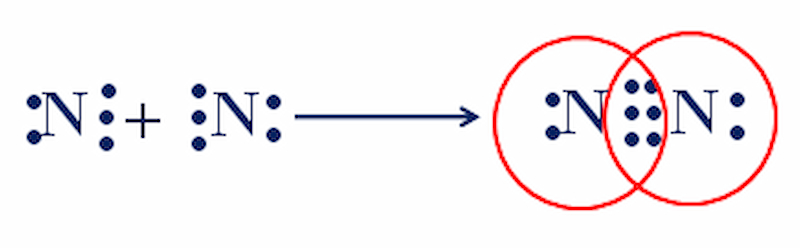
Hai nguyên tử N liên kết với nhau bằng 3 cặp electron. Liên kết được biểu thị bằng ba gạch (=), đây là liên kết ba.
-
Công thức electron: : N (6 chấm) N :
-
Công thức cấu tạo: N (3 gạch) N
Liên kết này bền nên khiến khí nitơ kém hoạt động hoá học ở nhiệt độ thường.
|
Kết luận: Từ sự hình thành phân tử Nitơ và Hidro ở trên, ta có kết luận về liên kết cộng hóa trị như sau:
|
Liên kết giữa các nguyên tử khác nhau – Sự hình thành hợp chất
Cùng tìm hiểu sự hình thành hợp chất - liên kết giữa các nguyên từ khác nhau thông qua sự hình thành của Hidro clorua (HCl) và khí cacbon dioxit (CO2).
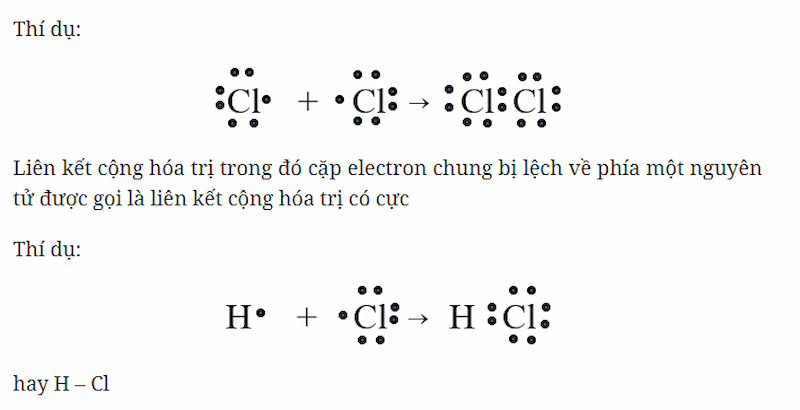
Sự hình thành phân tử hidro clorua (HCl)
Trong phân tử hiđro clorua, mỗi nguyên tử H và C góp 1 electron tạo thành 1 cặp electron chung.
Độ âm điện của clo là 3,16 lớn hơn độ âm điện của hidro là 2,20 => Cặp electron liên kết bị lệch về phía Clo, đây là một liên kết cộng hoá trị phân cực.
Kết luận:
-
Liên kết cộng hoá trị có cực: Liên kết cộng hóa trị trong đó cặp electron chung bị lệch về phía một nguyên tử.
-
Trong công thức electron của phân tử có cực, người ta đặt cặp electron chung lệch về phía kí hiệu của nguyên tử có độ âm điện lớn hơn. Ví dụ: H :CI
Sự hình thành phân tử khí cacbon dioxit (CO2) (có cấu tạo thẳng):
Cấu hình electron của C (Z = 6) là 1s22s22p2 với 4 e ở lớp ngoài cùng.
Cấu hình electron của O (Z = 8) là 1s22s22p4 với 6 electron ở lớp ngoài cùng.
Trong phân tử CO2, nguyên tử C ở giữa 2 nguyên tử O. Nguyên tử C góp chung với mỗi nguyên tử O 2 e, mỗi nguyên tử O góp chung với nguyên tử C 2 e tạo ra 2 liên kết đôi.
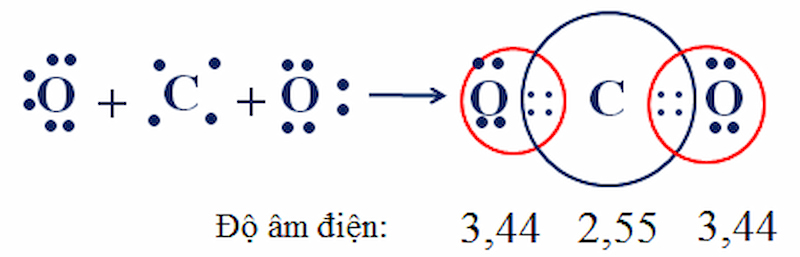
Từ sự hình thành của CO2, ta có nhận xét:
-
Theo công thức electron, mỗi nguyên tử C hay O đều có 8 electron ở lớp ngoài cùng, đạt cấu hình bền vững của khí hiếm.
-
Độ âm điện của oxi là 3,44 lớn hơn độ âm điện của C là 2,55 => Cặp electron chung lệch về phía oxi.
-
Liên kết giữa oxi và cacbon là phân cực, nhưng CO2 có cấu tạo thẳng nên hai liên kết đôi phân cực (C = 0) triệt tiêu nhau. Kết quả: CO2 là phân tử không bị phân cực.
Liên kết cộng hóa trị có mấy loại?
Như chúng ta đã biết, liên kết cộng hóa trị là một liên kết hóa học được hình thành bằng việc dùng chung một hay nhiều cặp electron giữa các nguyên tử. Vậy liên kết cộng hóa trị có mấy loại? Cùng Monkey tìm hiểu phân loại của liên kết cộng hóa trị trong phần này.
1. Liên kết cộng hóa trị có cực
Liên kết cộng hóa trị có cực được tạo thành khi các electron dùng chung giữa các nguyên tử không được chia sẻ bằng nhau.
-
Điều kiện xảy ra: Một bên nguyên tử có độ âm điện cao hơn bên còn lại (sẽ có lực hút mạnh hơn). Chính vì thế, việc chia sẻ các electron không đồng đều.
-
Đặc điểm: Phân tử nghiêng về phía chứa nguyên tử có độ âm điện thấp hơn, còn phía hơi âm chứa nguyên tử có độ âm điện cao hơn.
-
Kết quả: Hợp chất cộng hóa trị được hình thành sẽ có một thế tĩnh điện.
2. Liên kết hóa trị không cực
Liên kết cộng hóa trị không cực được tạo ra khi các nguyên tử chia sẻ các electron là bằng nhau.
Điều kiện xảy ra: Cả hai nguyên tử có lực tương tự hoặc cùng điện từ. Trong đó, các giá trị lực điện tử của chúng càng gần nhau thì sức hút càng mạnh. Điều này cùng xảy ra trong các phân tử khí (diatomic).
3. Liên kết đơn phân tử
Liên kết đơn phân tử xảy ra khi hai phân tử đều chỉ chia sẻ một cặp electron duy nhất. So với liên kết đôi và ba, liên kết đơn yếu hơn và mật độ nhỏ hơn nhưng lại là liên kết ổn định nhất. Nguyên nhân là do mức độ phản ứng của liên kết thấp, đồng nghĩa với việc khi bị mất e sẽ ít bị ảnh hưởng.
4. Liên kết đôi phân tử
Liên kết đôi phân tử là tên gọi của hiện tượng: Hai nguyên tử chia sẻ hai cặp e cho nhau. Liên kết này được biểu diễn bằng hai đường gạch ngang giữa hai nguyên tử trong cùng một phân tử. Liên kết này mạnh hơn so với liên kết đơn nhưng kém ổn định hơn.
5. Liên kết ba phân tử
Liên kết ba phân tử là liên kết kém ổn định nhất trong số các liên kết cộng hóa trị. Liên kết này xảy ra khi có ba cặp electron được chia sẻ giữa hai nguyên tử trong cùng một phân tử.
Tính chất của hợp chất cộng hóa trị
Các chất có liên kết cộng hóa trị mang những tính chất nổi bật sau đây:
-
Dạng tồn tại: Các chất mà phân tử chỉ có liên kết cộng hóa trị có thể là chất rắn (đường, sắt, lưu huỳnh,…), chất lỏng (rượu, nước,…) hoặc chất khí (clo, cacbonic, hidro,…). Các chất này thường có điểm nóng chảy và điểm sôi khá thấp, có entanpi hóa hơi cùng nhiệt hạch thấp hơn.
-
Ở những chất có cực: Ví dụ như đường, ancol etylic,… sẽ tan nhiều trong dung môi có cực như nước.
-
Ở những chất không cực: Ví dụ như ion, lưu huỳnh... tan trong những dung môi không cực như cacbon tetraclorua, benzen,.. Các chất chỉ có liên kết cộng hóa trị ko cực không có khả năng dẫn điện ở mọi trạng thái.
|
GIÚP CON HỌC TOÁN KẾT HỢP VỚI TIẾNG ANH SIÊU TIẾT KIỆM CHỈ TRÊN MỘT APP MONKEY MATH. VỚI NỘI DUNG DẠY HỌC ĐA PHƯƠNG PHÁP GIÚP BÉ PHÁT TRIỂN TƯ DUY NÃO BỘ VÀ NGÔN NGỮ TOÀN DIỆN CHỈ VỚI 2K/NGÀY.
|
Mối liên hệ giữa liên kết cộng hóa trị không cực, liên kết cộng hóa trị có cực và liên kết ion
Vậy mối quan hệ giữa liên kết cộng hóa trị có cực, liên kết cộng hóa trị không cực và liên kết ion như thế nào?
-
Trong phân tử, nếu cặp electron chung ở giữa 2 nguyên tử ta có liên kết cộng hoá trị không cực.
-
Trong phân tử, nếu cặp electron chung lệch về 1 phía của nguyên tử có độ âm điện lớn hơn, đó là liên kết cộng hoá trị có cực.
-
Trong phân tử, nếu cặp electron chung lệch hẳn về 1 nguyên tử, ta sẽ có liên kết ion.
Như vậy, liên kết ion được coi là trường hợp riêng đặc biệt của liên kết cộng hóa trị.
Hiệu độ âm điện và liên kết hóa học
Người ta sử dụng hiệu độ âm điện để đánh giá các loại liên kết trong phân tử hợp chất. Cụ thể, cách phân loại liên kết hóa học một cách tương đối theo thang độ âm điện của Pau - Linh như sau:
|
Liên kết |
Hiệu độ âm điện |
|
Từ 0 đến <0,4 |
Liên kết cộng hóa trị không cực |
|
Từ 0,4 đến <1,7 |
Liên kết cộng hóa trị có cực |
|
>= 1,7 |
Liên kết ion |
Thực tế, hiệu độ âm điện chỉ cho ta dự đoán về mặt lý thuyết loại liên kết trong phân tử. Ta có ví dụ về hiệu độ âm điện và liên kết hóa học như sau:
-
Phân tử NaCl có hiệu độ âm điện = 3,16 – 0,93 = 2,23 > 1,7 => Như vậy, liên kết giữa Na và C là liên kết ion.
-
Phân tử HCL có hiệu độ âm điện = 3,16 – 2,2 = 0,96 => Như vậy, liên kết giữa H và C là liên kết cộng hoá trị có cực.
-
Phân tử H2 có hiệu độ âm điện = 220 – 2,20 = 0,0 => Như vậy, đây là liên kết cộng hoá trị không cực.

Monkey Math - Ứng dụng học toán tiếng Anh chỉ với 2K/Ngày

Quy tắc hóa trị là gì? Vận dụng quy tắc hóa trị như thế nào?

Tinh thể nguyên tử và tinh thể phân tử: Khái niệm, tính chất và bài tập thực hành
Bài tập về liên kết cộng hóa trị SGK Hóa học 10 kèm lời giải
Cùng áp dụng những kiến thức đã học trên để thực hành một số bài tập Hóa học 10 về liên kết cộng hóa trị sau đây.

Bài 1 (trang 64 SGK Hóa 10):
Liên kết cộng hóa trị là liên kết
A. Giữa các phi kim với nhau.
B. Trong đó cặp electron chung bị lệch về một nguyên tử.
C. Được hình thành do sự dùng chung electron của 2 nguyên tử khác nhau.
D. Được tạo nên giữa 2 nguyên tử bằng một hay nhiều cặp electron chung.
Lời giải: D là đáp án đúng.
Bài 2 (trang 64 SGK Hóa 10):
Chọn câu đúng trong các câu sau:
A. Trong liên kết cộng hóa trị cặp electron lệch về phía nguyên tử có độ âm điện nhỏ hơn.
B. Liên kết cộng hóa trị có cực được tạo thành giữa 2 nguyên tử có hiệu độ âm điện từ 0,4 đến nhỏ hơn 1,7.
C. Liên kết cộng hóa trị không có cực được tạo nên từ các nguyên tử khác hẳn nhau về tính chất hóa học.
D. Hiệu độ âm điện giữa 2 nguyên tử lớn thì phân tử phân cực yếu.
Lời giải: B là đáp án đúng.
Bài 3 (trang 64 SGK Hóa 10):
Độ âm điện của một nguyên tử đặc trưng cho
A. Khả năng hút electron của nguyên tử đó khi hình thành liên kết hóa học.
B. Khả năng nhường electron của nguyên tử đó cho nguyên tử khác.
C. Khả năng tham gia phản ứng mạnh hay yếu của nguyên tử đó.
D. Khả năng nhường proton của nguyên tử đó cho nguyên tử khác.
Chọn đáp án đúng.
Lời giải: A là đáp án đúng.
Bài 4 (trang 64 SGK Hóa 10)
Thế nào là liên kết ion, liên kết cộng hóa trị không cực, liên kết cộng hóa trị có cực, liên kết cộng hóa trị có cực. Cho thí dụ minh họa.
Lời giải:
Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa các ion mang điện trái dấu.
Thí dụ : K+ + Cl- → KCl.
Liên kết cộng hóa trị không cực là liên kết được tạo nên giữa hai nguyên tử bằng những cặp electron chung.
Bài tập vận dụng về cộng hóa trị để học sinh tự luyện
Ngoài bài tập trong SGK Hóa Học 10, dưới đây cũng sẽ là một số bài tập liên quan để học sinh cùng luyện tập:
Câu 1. Xét các phân tử ion: LiCl, KCl, RbCl, CsCl. Liên kết trong phân tử nào mang tính chất ion nhiều nhất?
A. LiCl
B. KCl
C. RbCl
D. CsCl
Câu 2. Cho độ âm điện: Be (1,5), Al (1,5), Mg (1,2), Cl (3,0), N (3,0), H (2,1), S (2,5), O (3,5). Chất nào sau đây có liên kết ion ?
A. H2S, NH3.
B. BeCl2, BeS.
C. MgO, Al2O3.
D. MgCl2, AlCl3.
Câu 3. Nguyên tử Al có 3 electron hóa trị. Kiểu liên kết hóa học nào được hình thành khi nó liên kết với 3 nguyên tử flo:
A. Liên kết kim loại.
B. Liên kết cộng hóa trị có cực.
C. Liên kết cộng hóa trị không cực.
D. Liên kết ion.
Câu 4. Cho các hợp chất: NH3, H2O, K2S, MgCl2, Na2O, CH4, Chất có liên kết ion là:
A. NH3, H2O, K2S, MgCl2
B. K2S, MgCl2, Na2O, CH4
C. NH3, H2O, Na2O, CH4
D. K2S, MgCl2, Na2O
Câu 5. Cấu hình electron của cặp nguyên tử nào sau đây có thể tạo liên kết ion:
A. 1s22s22p3 và 1s22s22p5
B.1s22s1 và 1s22s22p5
C. 1s22s1 và 1s22s22p63s23p2
D.1s22s22p1 và 1s22s22p63s23p6
Câu 6. Cho 3 ion : Na+, Mg2+, F- . Tìm câu khẳng định sai .
A. 3 ion trên có cấu hình electron giống nhau .
B. 3 ion trên có số nơtron khác nhau.
C. 3 ion trên có số electron bằng nhau
D. 3 ion trên có số proton bằng nhau.
Câu 7. Trong dãy oxit sau: Na2O, MgO, Al2O3 , SiO2 , P2O5 , SO3 , Cl2O7 . Những oxit có liên kết ion là :
A. Na2O , SiO2 , P2O5 .
B. MgO, Al2O3 , P2O5
C. Na2O, MgO, Al2O3 .
D. SO3, Cl2O3 , Na2O .
Câu 8. Cho các chất : HF, NaCl, CH4, Al2O3, K2S, MgCl2. Số chất có liên kết ion là (Độ âm điện của K: 0,82; Al: 1,61; S: 2,58; Cl: 3,16 và O: 3,44; Mg: 1,31; H: 2,20; C: 2,55; F: 4,0) :
A. 3.
B. 2.
C. 1.
D. 4.
Câu 9: Cho các hợp chất: NH3, Na2S, CO2, CaCl2, MgO, C2H2. Hợp chất có liên kết CHT là:
A. CO2, C2H2, MgO
B. NH3.CO2, Na2S
C. NH3 , CO2, C2H2
D. CaCl2, Na2S, MgO
Câu 10: Cho độ âm điện Cs: 0,79; Ba: 0,89; Cl: 3,16; H: 2,2; S: 2,58; F: 3,98: Te: 2,1 để xác định liên kết trong phân tử các chất sau: H2Te , H2S, CsCl, BaF2 . Chất có liên kết cộng hóa trị không phân cực là:
A. BaF2.
B. CsCl
C. H2Te
D. H2S.
Câu 11: Liên kết cộng hóa trị là liên kết giữa 2 nguyên tử trong phân tử bằng:
A. 1 cặp electron chung
B. 2 cặp electron chung
C. 3 cặp electron chung
D. 1 hay nhiều cặp electron chung
Câu 12: Số oxi hóa của nitơ trong NH4+, NO2- , và HNO3 lần lượt là:
A. +5, -3, +3.
B. -3, +3, +5
C. +3, -3, +5
D. +3, +5, -3.
Câu 13: Cho các phân tử sau : C2H2 (1) ; BF3 (2) ; BeCl2 (3) ; C2H4 (4) ; CH4 (5) ; Cl2 (6) ; H2 (7) ; H2O (8) ; NH3 (9) ; HCl (10). Trong các phân tử trên, sự hình thành liên kết trong các phân tử nhờ :
a. Sự lai hoá sp các AO hoá trị là :
A. (1), (3), (6).
B. (1), (2), (3), (5).
C. (1), (3), (4), (7).
D. (1), (3).
Câu 14: Hóa trị và số oxi hóa của N trong phân tử NH4Cl lần lượt là
A. 4 và -3
B. 3 và +5
C. 5 và +5
D. 3 và -3
Câu 15: Xác định số oxi hóa của các nguyên tố trong hợp chất , đơn chất và ion sau:
a) H2S, S, H2SO3, H2SO4.
b) HCl, HClO, NaClO2, HClO3.
c) Mn, MnCl2, MnO2, KMnO4.
Như vậy, thông qua bài viết này, chúng ta đã hiểu rõ liên kết cộng hóa trị là gì, bên cạnh phân loại, tính chất và cùng thực hành một số bài tập cơ bản trong SGK Hóa 10. Hy vọng những thông tin này sẽ giúp bạn biết thêm nhiều kiến thức bổ ích và thành thạo hơn trong những dạng bài tập về liên kết cộng hóa trị. Truy cập website của Monkey để cập nhập thêm nhiều thông tin thú vị về môn Hóa học nhé!
Covalent Bond - Ngày truy cập: 15/06/2022
https://en.wikipedia.org/wiki/Covalent_bond
Covalent Bond - Definition, Types, Properties, and Examples - Ngày truy cập: 15/06/2022









.png)
.png)






.png)