Mọi vật thể quanh ta, từ tự nhiên đến nhân tạo, đều được tạo nên từ các chất. Nhưng những chất đó đến từ đâu?
Câu hỏi đã được con người đặt ra hàng nghìn năm trước, và lời giải nằm ở khái niệm “nguyên tử”. Hãy cùng Monkey khám phá chi tiết trong bài viết tổng hợp dưới đây!
.png)
Video bài giảng
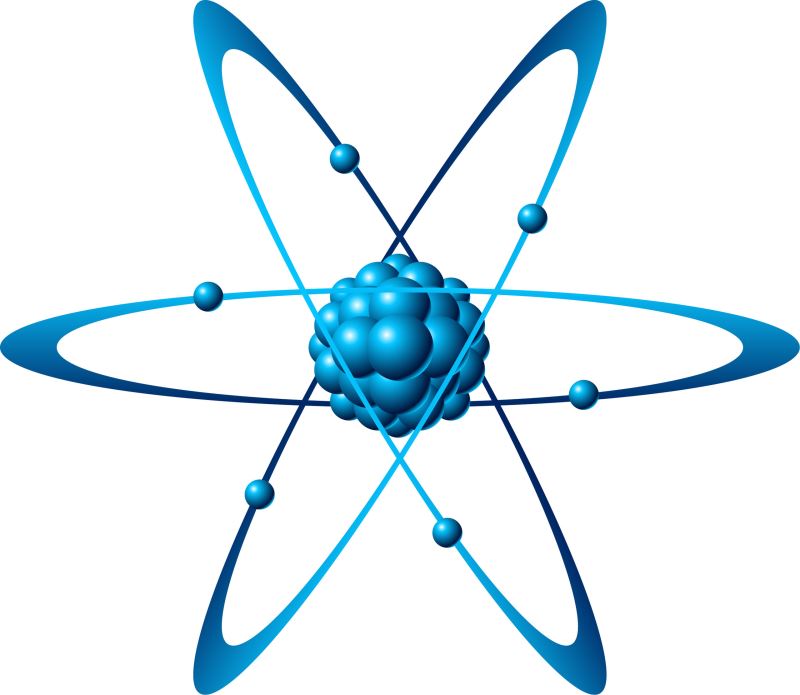
Nguyên tử là gì?
Thực tế có đến hàng chục triệu chất khác nhau nhưng chỉ có khoảng hơn 100 loại nguyên tử. Nguyên tử được hình dung giống như một quả cầu rất bé nhỏ, đường kính chỉ khoảng 0.00000001 cm.
Sách giáo khoa Hóa học 8 (Nhà xuất bản Giáo dục Việt Nam) định nghĩa về nguyên tử như sau:
“Nguyên tử là hạt vô cùng nhỏ và trung hòa về điện. Nguyên tử gồm hạt nhân mang điện tích dương và vỏ tạo bởi một hay nhiều electron mang điện tích âm”.
Electron ký hiệu là e có điện tích âm nhỏ nhất và được quy ước ghi bằng dấu âm (-).

Bí kíp giúp trẻ 10 tuổi giỏi cả 4 kĩ năng tiếng Anh

Gợi ý bài tập ứng dụng đạo hàm trong kinh tế và cách học hiệu quả

Oxit axit: Định nghĩa, cách gọi tên, tính chất và bài tập thực hành
Cấu tạo của nguyên tử
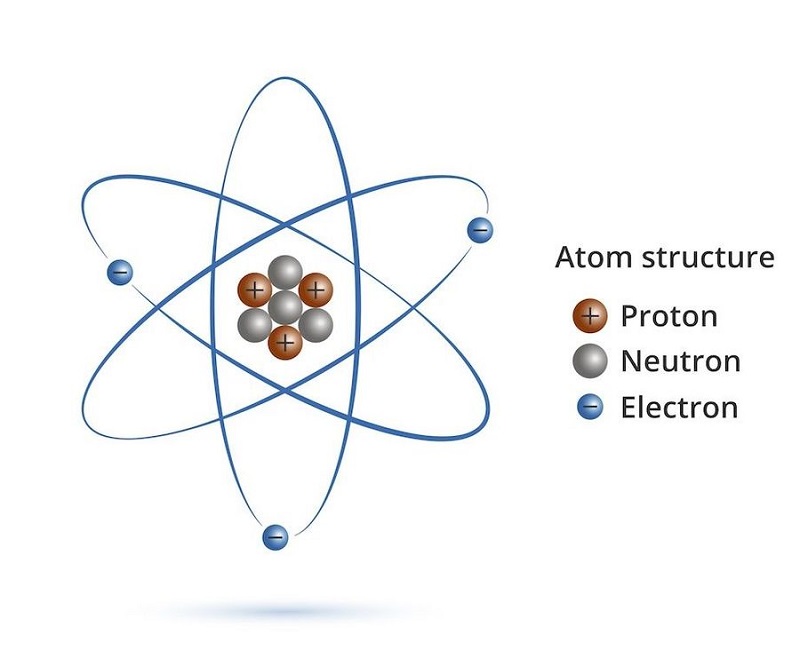
Dựa vào định nghĩa nguyên tử là gì ở trên ta có thể nhận thấy rõ ràng rằng, nguyên tử được cấu tạo bởi 2 loại, bao gồm hạt nhân mang điện tích dương và vỏ tạo bởi một hay nhiều electron mang điện tích âm.
Các khái niệm khác về nguyên tử
Để hiểu rõ bản chất nguyên tử là gì, chúng ta cũng nên tìm hiểu một số khái niệm liên quan đến nguyên tử, bao gồm hạt nhân nguyên tử, lớp electron trong nguyên tử hay định nghĩa về nguyên tử khối.

1. Hạt nhân nguyên tử
Hạt nhân nguyên tử được tạo bởi proton và nơtron, nằm ở trung tâm của nguyên tử. Proton ký hiệu là p và có điện tích như electron nhưng khác dấu (ghi bằng dấu dương +). Nơtron không mang điện, ký hiệu là n. Các nguyên tử cùng loại đều có số proton trong hạt nhân.
Trong một nguyên tử có bao nhiêu proton thì cũng có bấy nhiêu electron. Kết luận số p = số e. Thực tế, proton và nơtron có cùng khối lượng còn electron có khối lượng rất nhỏ, chỉ bằng khoảng 0.0005 lần proton. Vì vậy, các nhà khoa học coi khối lượng hạt nhân chính là khối lượng của nguyên tử.
2. Lớp e trong nguyên tử
Trong nguyên tử thì electron luôn chuyển động rất nhanh quanh hạt nhân và sắp xếp thành từng lớp với số electron nhất định. Và nhờ electron mà nguyên tử có khả năng liên kết với nhau.
Học thêm: Cấu hình electron nguyên tử
3. Số nguyên tử
Trên bảng tuần hoàn hóa học, mỗi phân tử đều có số nguyên tử riêng của nó. Dựa vào số nguyên tử, chúng ta có thể phân biệt một phần tử này với các phần tử khác.
Số nguyên tử là gì? Số nguyên tử chính là số lượng proton được tìm thấy trong hạt nhân nguyên tử của nguyên tố hóa học đó. Trong trường hợp nguyên tử đó không có điện tích thì số lượng nguyên tử bằng số electron.
4. Nguyên tử khối
“Nguyên tử khối là khối là khối lượng của một nguyên tử tính bằng đơn vị cacbon. Mỗi nguyên tố có nguyên tử khối riêng biệt” (Sách giáo khoa Hóa học 8, Nhà xuất bản Giáo dục Việt Nam).
Chính bởi nguyên tử có khối lượng rất nhỏ, không tiện sử dụng nên các nhà khoa học đã quy ước lấy 1/12 khối lượng của nguyên tử cacbon làm đơn vị khối lượng cho nguyên tử (viết tắt đvC).
Xem thêm: Nguyên tử khối là gì? Tìm hiểu chi tiết từ A-Z
Phân biệt nguyên tử và phân tử
Trong quá trình tìm hiểu về nguyên tử, không ít các bạn nhầm lẫn nguyên tử và phân tử. Vậy phân tử và nguyên tử khác nhau chỗ nào? Dưới đây là bảng so sánh:
|
Đặc điểm so sánh |
Nguyên tử |
Phân tử |
|
Khái niệm |
Nguyên tử là hạt vô cùng nhỏ và trung hòa về điện. Nguyên tử gồm hạt nhân mang điện tích dương và vỏ tạo bởi một hay nhiều electron mang điện tích âm. |
Phân tử là hại đại diện cho chất, gồm một số nguyên tử liên kết với nhau và thể hiện đầy đủ tính chất hóa học của chất. |
|
Ví dụ |
Nguyên tử oxi, nguyên tử cacbon |
Oxy (O2), nước (H2O) |
|
Hình dạng |
Hình cầu |
Nhiều hình dáng |
|
Tính chất |
Không thể phân đôi nguyên tử |
Các nguyên tố trong phân tử có thể tách rời và kết hợp với nhau. |
|
Sự tồn tại |
Có thể tồn tại hoặc không tồn tại ở trạng thái tự do |
Tồn tại trong trạng thái tự do |
|
Tầm nhìn |
Không nhìn thấy bằng mắt thường |
Không thể nhìn thấy bằng mắt thường nhưng nếu có kính hiển vi vẫn có thể quan sát |
|
Khả năng phản ứng |
Phản ứng cao, có ngoại lệ nhất định |
Ít phản ứng |
|
Liên kết |
Liên kết hạt nhân |
Lịch sử nguyên tử (kiến thức nâng cao)
1. Nguyên tử luận
Khái niệm vật chất được tạo bởi những hạt nhỏ, rời rạc đã xuất hiện từ rất sớm và chủ yếu dựa trên tư duy triết học. Về sau, khoa học chấp nhận nguyên tử vì nó giải thích đơn giản nhiều hiện tượng hóa học.
Từ thế kỷ VI–V TCN, các trường phái triết học Ấn Độ và Hy Lạp như Ājīvika, Jain, Leucippus và Democritos đã đưa ra thuyết nguyên tử. Democritos đặt tên atomos với nghĩa “không thể cắt được”, và thuật ngữ này tồn tại đến hiện đại.
Đến Trung Cổ và cận đại, các học giả như Geber, Boyle và Newton phát triển thêm thuyết “tiểu thể”. Họ cho rằng vật chất gồm những hạt rất nhỏ, có thể phân chia và kết hợp để tạo nên cấu trúc phức tạp hơn.
2. Nguồn gốc lý thuyết khoa học
Nghiên cứu nguyên tử chỉ thật sự hình thành khi hóa học phát triển. Năm 1789, Lavoisier phát hiện định luật bảo toàn khối lượng và xem nguyên tố là chất không thể tách bằng phương pháp hóa học.
Năm 1805, John Dalton dùng khái niệm nguyên tử để giải thích tỉ lệ phản ứng tự nhiên giữa các nguyên tố. Ông cho rằng mỗi nguyên tố gồm các nguyên tử cùng loại và chúng kết hợp với nhau tạo thành hợp chất.
Từ các quan sát và thí nghiệm sau đó, như đo kích thước phân tử của Loschmidt hay chuyển động Brown được Einstein và Perrin chứng minh, lý thuyết nguyên tử ngày càng được xác nhận. Đến năm 1869, Mendeleev hoàn thiện bảng tuần hoàn, củng cố cấu trúc và quy luật của các nguyên tố hóa học.
3. Hạt cấu thành và lý thuyết lượng tử
Cuối thế kỷ XIX, J. J. Thomson phát hiện electron và chứng minh nguyên tử có thể phân chia. Thí nghiệm tiếp theo của Rutherford cho thấy điện tích dương và phần lớn khối lượng tập trung tại hạt nhân.
Đầu thế kỷ XX, các nhà khoa học khám phá đồng vị và cấu trúc quỹ đạo electron, trong đó mô hình Bohr giải thích sự nhảy mức năng lượng và phổ vạch hydro. Moseley sau đó chứng minh số nguyên tử chính là điện tích hạt nhân, đặt nền móng cho mô hình nguyên tử hiện đại.
Từ thập niên 1920, cơ học lượng tử phát triển với các phát hiện như spin (Stern–Gerlach), tính sóng của hạt (de Broglie), và mô hình hàm sóng của Schrödinger. Sự ra đời của neutron năm 1932 giúp giải thích vì sao các đồng vị khác nhau về số neutron nhưng cùng số proton.
4. Phân hạch, vật lý năng lượng cao và vật chất ngưng tụ
Năm 1938, Otto Hahn phát hiện phản ứng phân hạch khi chiếu neutron vào nguyên tử urani và thu được bari. Một năm sau, Meitner và Frisch xác nhận đây là bằng chứng đầu tiên của phân hạch hạt nhân.
Đến thập niên 1950, máy gia tốc và máy dò hạt mở ra khả năng nghiên cứu va chạm ở năng lượng cao. Từ đó, các nhà khoa học phát hiện proton và neutron không phải hạt cơ bản mà được cấu tạo từ quark.
Những kết quả này góp phần hình thành Mô hình Chuẩn - lý thuyết mô tả các hạt hạ nguyên tử và các tương tác cơ bản trong thế giới lượng tử. Đây hiện là nền tảng của vật lý hạt hiện đại.

Bài tập về nguyên tử (có đáp án)
Sau khi nắm vững lý thuyết, bạn đừng quên làm các bài tập trong sách giáo khoa, sách bài tập hay sách bổ trợ để ghi nhớ kiến thức chắc hơn nhé. Dưới đây là một vài bài tập Monkey tổng hợp từ sách giáo khoa Hóa học 8 (NXB Giáo dục Việt Nam) cùng gợi ý đáp án để bạn tham khảo.
Bài 1: Ôn tập khái niệm nguyên tử
“(1) là hạt vô cùng nhỏ, trung hòa về điện: từ (2) tạo ra mọi chất. Nguyên tử gồm (3) mang điện tích dương và vỏ tạo bởi (4)”.
Gợi ý đáp án:
(1): Nguyên tử
(2): nguyên tử
(3) hạt nhân
(4) một hay nhiều electron mang điện tích âm
Bài 2: Bài tập ôn tập SGK Hóa học 8 trang 25
Kim loại đồng, sắt được tạo nên từ nguyên tố nào? Nêu sự sắp xếp nguyên tử trong đơn chất kim loại.
Gợi ý đáp án:
Kim loại đồng được tạo nên từ nguyên tố Cu; kim loại sắt được tạo nên từ nguyên tố Fe;
Sự sắp xếp nguyên tử trong đơn chất kim loại: Chúng được sắp xếp khít nhau và theo một trật tự xác định.
FAQ - Những thắc mắc khác về nguyên tử
1. Các hạt cấu tạo nên hầu hết các nguyên tử là gì?
Chủ yếu gồm electron, proton và neutron.
2. Một nguyên tử được đặc trưng cơ bản bằng yếu tố nào?
Bằng số proton trong hạt nhân (cũng chính là số nguyên tử).
3. Hạt mang điện trong hạt nhân nguyên tử là gì?
Đó là proton (mang điện tích dương).
4. Khối lượng nguyên tử tập trung ở đâu?
Gần như toàn bộ tập trung ở hạt nhân.
5. Cấu tạo của nguyên tử gồm những phần nào?
Gồm hạt nhân (proton, neutron) và lớp vỏ electron.
6. Mô hình cấu tạo nguyên tử mô tả điều gì?
Mô tả nguyên tử gồm hạt nhân ở trung tâm và electron phân bố trong các lớp vỏ theo mô hình lượng tử.
7. Số nguyên tử là gì?
Là số proton trong hạt nhân, dùng để xác định nguyên tố.
8. Kích thước nguyên tử khoảng bao nhiêu?
Rất nhỏ, vào khoảng 0,1 – 0,5 nanomet.
9. Hạt nhân nguyên tử mang điện tích gì?
Mang điện tích dương (do proton tạo ra).
Nguyên tử là bài học quan trọng trong chương trình Hóa học THCS. Vì vậy, các bạn đừng quên ôn tập kiến thức thật kỹ cũng như làm bài tập đầy đủ để nắm vững kiến thức về bài học này nhé. Monkey chúc các bạn học tập thật tốt!
1. Lý thuyết thành phần nguyên tử | SGK Hóa lớp 10 (Tham khảo ngày 19/11/25)
2. Atomic structure - AQA: https://www.bbc.co.uk/bitesize/guides/zwn8b82/revision/3 (Tham khảo ngày 19/11/25)
3. Atomic structure: https://www.arpansa.gov.au/understanding-radiation/what-is-radiation/ionising-radiation/atomic-structure (Tham khảo ngày 19/11/25)










.png)
.png)






.png)