Số oxi hóa là gì và làm sao xác định nhanh trong các chất hóa học? >>> Số oxi hóa là đại lượng cho biết mức độ mất hay nhận electron của một nguyên tố trong hợp chất.
Bài viết này giúp bạn nắm ngay 4 quy tắc xác định số oxi hóa chuẩn SGK, dễ nhớ, dễ áp dụng vào mọi bài tập oxi hóa - khử chỉ trong vài phút.
.png)
Video bài giảng
Hóa trị là gì?
Hóa trị là chỉ số cho biết một nguyên tử có thể liên kết với bao nhiêu nguyên tử khác.
Đối với hợp chất ion, hóa trị tương ứng với điện tích của ion; còn trong hợp chất cộng hóa trị, hóa trị cho biết số liên kết mà nguyên tử đó tạo ra.
Số oxi hóa là gì?
Số oxi hóa là con số quy ước được gán cho mỗi nguyên tử để giúp ta xác định nó mất hay nhận electron trong phản ứng oxi hóa - khử. Số này được viết bằng chữ số thường, có dấu (+) hoặc (–) đặt phía trước, và được ghi ở phía trên kí hiệu nguyên tố theo các quy tắc nhất định.

Cách xác định số oxi hóa (4 quy tắc quan trọng)
Chúng ta có thể xác định số oxi hóa dựa trên quy tắc hóa học hoặc áp dụng mẹo để tính trong trường hợp các nguyên tử không có quy tắc riêng về số oxi hóa.
1. Xác định số oxi hóa dựa trên các quy tắc hóa học
Số oxi hóa của một nguyên tố được gán cho nguyên tử của nguyên tố đó theo các quy tắc sau:
-
Quy tắc 1: Trong các đơn chất, số oxi hóa của nguyên tố bằng 0. Ví dụ: Số oxi hóa của các nguyên tố Cu, Zn, H, N, O trong đơn chất Cu, Zn, H2, N2, O2… đều bằng 0.
-
Quy tắc 2: Trong một phân tử, tổng số oxi hóa của các nguyên tố nhân với số nguyên tử của từng nguyên tố bằng 0.
-
Quy tắc 3: Trong ion nguyên tử, số ion hóa của nguyên tố bằng điện tích của ion đó. Trong ion đa nguyên tử, tổng số oxi hóa của các nguyên tố nhân với số nguyên tử của từng nguyên tố bằng điện tích của ion.
-
Quy tắc 4: Trong hầu hết các hợp chất, số oxi hóa của hiđro bằng +1, trừ một số trường hợp hidro kim loại (naH, CaH2…). Số oxi hóa của oxi bằng -2, trừ trường hợp OF2, peoxit (chẳng hạn H2O2).

Ví dụ 1: Số oxi hóa của các nguyên tố ở các ion K+; Ca 2+; Cl-; S 2- lần lượt bằng +1, +2, -1, -2.
Ví dụ 2: Tính số oxi hóa (X) của nitơ trong amoniac NH3, axit nitro HNO2 và anion nitrat NO3-.
-
Trong NH3: X + 3 x (+1) = 0 => X = -3.
-
Trong HNO2: (+1) + X + 2 x (-2) = 0 => X = +3.
-
Trong NO3-: X + 3 x (-2) = -1 => X = +5.
|
GIÚP CON HỌC TOÁN KẾT HỢP VỚI TIẾNG ANH SIÊU TIẾT KIỆM CHỈ TRÊN MỘT APP MONKEY MATH. VỚI NỘI DUNG DẠY HỌC ĐA PHƯƠNG PHÁP GIÚP BÉ PHÁT TRIỂN TƯ DUY NÃO BỘ VÀ NGÔN NGỮ TOÀN DIỆN CHỈ VỚI KHOẢNG 2K/NGÀY. |
2. Tìm số oxi hóa cho các nguyên tử không có nguyên tắc riêng về số oxi hóa
Trường hợp các nguyên tử không tuân theo quy tắc nhất định nào về số oxi hóa, nghĩa là ta không thể áp dụng 4 quy tắc đã có ở trên và cũng không hề biết rõ điện tích của nguyên tử đó chúng ta sẽ dùng phương pháp loại trừ để tìm số oxi hóa.
Cụ thể, chúng ta sẽ xác định số oxi hóa của tất cả các nguyên tử khác trong hợp chất, sau đó thực hiện giải bài toán tìm số chưa biết dựa trên điện tích tổng hợp của hợp chất.
-
Bước 1: Tìm số oxi hóa của các nguyên tử nguyên tố khác trong hợp chất bằng cách sử dụng các quy tắc gán số oxi hóa ở phần trên, ta có thể tìm được số oxi hóa của các nguyên tử nguyên tố khác trong hợp chất. Với các nguyên tố O, H… sẽ có trường hợp ngoại lệ.
-
Bước 2: Thực hiện nhân số nguyên tử của mỗi nguyên tố với số oxi tương ứng. Sau khi xác định được số oxi hóa của các nguyên tử trừ ẩn số, chúng ta cần xem xét số lượng nguyên tử của cùng một nguyên tố trong hợp chất là bao nhiêu. Tiếp tục nhân chỉ số được viết dưới chân nằm sau khí hiệu hóa học với số oxi hóa.
-
Bước 3: Cộng tổng các tích số tìm được. Lúc này ta sẽ có kết quả của tổng các tích số không xét đến số oxi hóa của nguyên tử cần tìm.
-
Bước 4: Tính số oxi hóa cần tìm dựa trên diện tích của hợp chất. Qua các giá trị đã tính được, bạn hãy tiếp tục thực hiện các phép tính cộng và trừ đơn giản để tìm số oxi hóa còn thiếu. Công thức tính là: Tổng oxi hóa đã biết + số oxi hóa cần tìm = điện tích tổng của hợp chất.

Ví dụ: Chúng ta cần xác định số oxi hóa của lưu huỳnh trong hợp chất Na2SO4 ta sẽ thực hiện các bước sau đây:
-
Bước 1: Ta xác định được số oxi hóa của natri và oxi lần lượt là +1 và -2.
-
Bước 2: Số oxi hóa của Na = 2 x (+1) = 2; O = 4 x (-2) = -8.
-
Bước 3: Tổng số oxi hóa của Na và O là 2 + (-8) = -6.
-
Bước 4: Gọi X là số oxi hóa của S ta có: -6 + X = 0 => X = +6

Monkey Math - Ứng dụng học toán tiếng Anh chỉ với 2K/Ngày
Chi tiết bảng tuần hoàn các nguyên tố hóa học 8 9 10 MỚI NHẤT

Quy tắc hóa trị là gì? Vận dụng quy tắc hóa trị như thế nào?
Bảng trạng thái oxy hóa của các nguyên tố
Bài tập về số oxi hóa SGK Hóa học 10 (+lời giải chi tiết)
Để hiểu về cách tính số oxi hóa rõ hơn, bạn hãy áp dụng những kiến thức lý thuyết Monkey đã tổng hợp trên đây để làm các bài tập trong sách giáo khoa. Dưới đây là tổng hợp một số bài tập kèm lời giải chi tiết để bạn tham khảo:

Bài tập 1 (SGK Hóa học 10, trang 74)
Số oxi hóa của nitơ trong NH4+, NO2- và HNO3 lần lượt là:
A. +5, - 3, +3.
B. -3, +3, +5.
C. +3, -3, +5.
D. +3, +5, -3.
Gợi ý đáp án:
Đáp án đúng là B. Giải thích:
Gọi số oxi hóa của N trong các hợp chất là X. Ta có:
- NH4+: X + 4 = 1 ⇒ X = -3 ⇒ Số oxi hóa của N trong NH4+ là -3.
- NO2-: X + 2 x (-2) = -1 ⇒ X = 3 ⇒ số oxi hóa của N trong NO2- là +3.
- HNO3: 1 + X + 3x (-2) = 0 ⇒ X = 5 ⇒ số oxi hóa của N trong HNO3 là +5.
Bài tập 2 (SGK Hóa học 10, trang 74)
Số oxi hóa của Mn, Fe trong Fe3+, Strong SO3, P trong PO43- lần lượt là:
A. 0, +3, +6, +5.
B. 0, +3, +5, +6.
C. +3, + 5, 0, +6
D. +5, +6, +3, 0.
Gợi ý đáp án:
Đáp án đúng là A. Giải thích:
Mn là đơn chất nên có số oxi hóa 0.
Fe3+ có số oxi hóa +3.
SO3: X + 3 x (-2) = 0 ⇒ X = 6 ⇒ Số oxi hóa của S là +6.
PO4(3)-: X + 4 x (-2) = -3 ⇒ X = 5 ⇒ Số oxi hóa của P là +5.
Bài tập 3 (SGK Hóa học 10 trang 74)
Xác định số oxi hóa của các nguyên tố trong các phân tử và ion sau: CO2, H2O, SO3, NH3, NO, NO2, Na+, Cu2+, Fe2+, Fe3+, Al3+.
Gợi ý đáp án:
O có số oxi hóa là -2; H có số oxi hóa là +1 => Số oxi hóa của các nguyên tố trong các phân tử và ion là:
-
CO2: X + 2 x (-2) = 0 ⇒ X = 4 ⇒ C có số oxi hóa +4 trong CO2
-
H2O: H có số oxi hóa +1, O có số oxi hóa -2.
-
SO3: X + 3 x (-2) = 0 ⇒ X = 6 ⇒ S có số oxi hóa +6 trong SO3
-
NH3: X + 3 x 1 = 0 ⇒ X = -3 ⇒ N có số oxi hóa -3 trong NH3
-
NO: X + 1 x (-2) = 0 ⇒ X = 2 ⇒ N có số oxi hóa +2 trong NO
-
NO2: X + 2 x (-2) = 0 ⇒ X = 4 ⇒ N có số oxi hóa +4 trong NO2
-
Cu2+ có số oxi hóa là +2.
-
Na+ có số oxi hóa là +1.
-
Fe2+ có số oxi hóa là +2.
-
Fe3+ có số oxi hóa là +3.
-
Al3+ có số oxi hóa là +3.
Xem thêm:
- Monkey Apps - Bộ ứng dụng học tập giúp trẻ phát triển toàn diện về tư duy và ngôn ngữ
- Phương trình hóa học là gì? Cách lập và cân bằng chính xác nhất
Bài tập về cách xác định số oxi hóa (tự luyện)
Dựa vào những kiến thức khái niệm và quy tắc xác định số oxi hóa trên, dưới đây là một số bài tập liên quan để các em học sinh có thể tự luyện tập hiệu quả nhé:
Câu 1: Số oxi hóa của nitơ trong NH4+, NO2- , và HNO3 lần lượt là:
A. +5, -3, +3.
B. -3, +3, +5
C. +3, -3, +5
D. +3, +5, -3.
Câu 2: Xác định số oxi hóa của các nguyên tố trong hợp chất, đơn chất và ion sau:
a) H2S, S, H2SO3, H2SO4.
b) HCl, HClO, NaClO2, HClO3.
c) Mn, MnCl2, MnO2, KMnO4.
Câu 3: Hóa trị và số oxi hóa của N trong phân tử NH4Cl lần lượt là
A. 4 và -3 B. 3 và +5
C. 5 và +5 D. 3 và -3
Câu 4: Xác định số oxi hóa của các nguyên tố trong phân tử và ion sau: CO2, H2O, SO3, NH3, NO2, Na+, Cu2+ , Fe2+ , Fe3+, Al3+
Câu 5: Xác định số oxi hóa của Mn, Cr, Cl, P trong phân tử: KMnO4 , Na2Cr2O7, KClO3, H3PO4
Câu 6: Xác định điện hóa trị của các nguyên tố trong các hợp chất sau: KCl, Na2S; Ca3N2.
Câu 7: Xác định số oxi hóa của cacbon trong mỗi phân tử sau:
CH3 – CH3; CH2= CH2; CH≡ CH; CH2 =CH-C≡CH;
CH3 – CH2OH; CH3 – CHO; CH3- COOH; CH3COOCH =CH2;
C6H5 – NO2; C6H5 – NH2
Câu 8: Xác định số oxi hóa của N, S, C, Br trong ion: NO3-, SO42- ; CO32- , Br, NH4+
Câu 9: Xác định sự thay đổi số oxi hóa:
Cr+2 → Cr+3
S-2 → S0
N+5 → N+4
Câu 10: Số oxi hóa của N, O, S, Cl, Br, Cr, Mn trong các chất và ion: NH4+, CH3COOH, SO42–, Cl2, KBrO3, K2Cr2O7, K2MnO4 lần lượt là:
A.+3, –2, +4, 0, +5, +6, +7.
B. –3, 0, +6, 0, +3, +7, +7.
C. –3, –2, +6, 0, +5, +6, +6.
D. –3, –2, +4, 0, +7, +6, +6.
FAQ - Những thắc mắc khác về số oxi hoá
1. Số oxi hóa và hóa trị có giống nhau không?
Không. Số oxi hóa là giá trị quy ước, còn hóa trị thể hiện khả năng liên kết thực tế của nguyên tử.
2. Làm sao biết nguyên tố nào có số oxi hóa âm hay dương?
Nếu nguyên tử nhận electron, số oxi hóa âm; nếu mất electron, số oxi hóa dương.
3. Trong phân tử có nhiều nguyên tố, xác định số oxi hóa theo thứ tự nào?
Xác định các nguyên tố có số oxi hóa quen thuộc trước (H, O, kim loại kiềm…), sau đó tính các nguyên tố còn lại.
4. Oxi luôn có số oxi hóa –2 đúng không?
Hầu hết đúng, nhưng có ngoại lệ như H₂O₂ (–1) hoặc OF₂ (+2).
5. Hiđro luôn có +1 đúng không?
Đúng trong đa số hợp chất, trừ khi kết hợp với kim loại (như NaH) thì H có số oxi hóa –1.
Trên đây là những thông tin tổng hợp về cách tính số oxi hóa của mỗi nguyên tố để bạn đọc tham khảo. Đừng quên chia sẻ nếu thấy bài viết hữu ích và ghé đọc website Monkey.edu.vn mỗi ngày để tham khảo thêm nhiều kiến thức hữu ích xung quanh các môn học và đời sống bạn nhé!
1. Oxidation number - Ngày truy cập 11/12/2025
https://www.britannica.com/science/reduction-chemistry
2. Oxidation number - Ngày truy cập 11/12/2025
https://byjus.com/jee/oxidation-number/






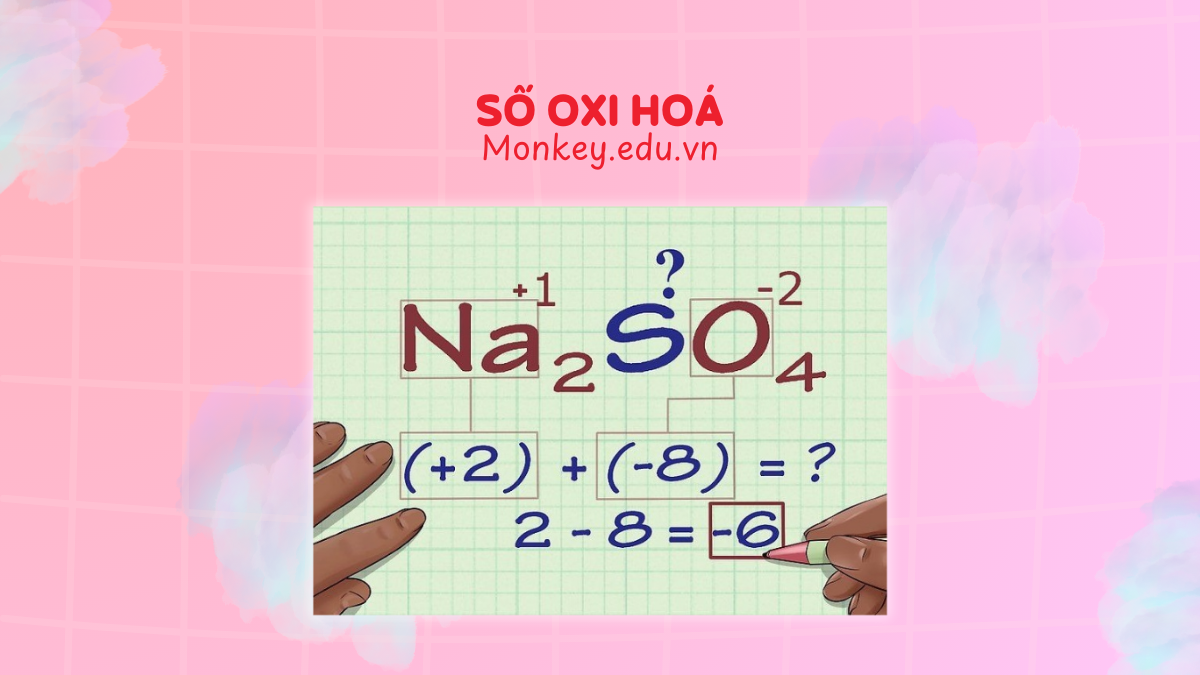
.png)
.png)







.png)