Axit photphoric (H3P04) là một hóa chất độc hại nhưng lại đóng vai trò quan trọng trong nhiều ngành công nghiệp sản xuất, đặc biệt là sản xuất phân bón và thuốc trừ sâu. Bạn biết gì về loại hóa chất này? Cùng Monkey tìm hiểu các thông tin quan trọng về axit photphoric trong bài viết sau!
.png)
Định nghĩa axit photphoric là gì?
Khái niệm: Axit photphoric được biết đến với các tên gọi khác như: Trihiđroxiđioxiđophotpho, axit phosphoric, axit orthophosphoric.
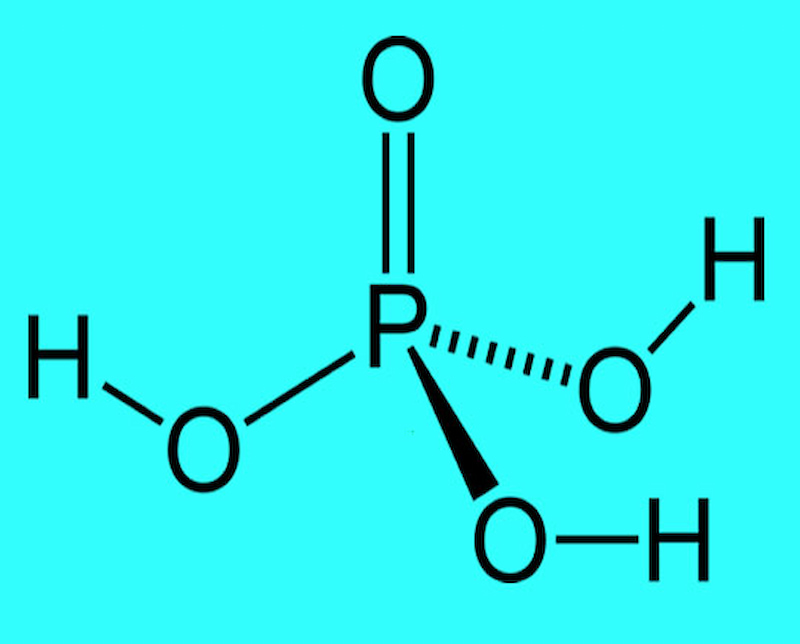
Công thức hóa học: H3PO4.
Cấu tạo phân tử: Axit photphoric có 3 nấc phân li. Cấu tạo phân tử của axit này bao gồm 3 phân tử hidro liên kết với gốc PO4.
Tính chất vật lý của axit photphoric
Axit photphoric là chất tinh thể trong suốt, tồn tại dưới 2 dạng: Chất rắn tinh thể không màu (tan vô hạn trong nước hoặc cồn với cấu trúc tứ diện đều) và chất lỏng trong suốt (không màu, có vị chua). Thông thường, axit photphoric được sử dụng dưới dạng dung dịch đặc, sánh, không có màu với nồng độ 85%.
-
Axit photphoric háo nước, dễ chảy rữa, tan vô hạn trong nước theo bất kì tỉ lệ nào.
-
Nhiệt độ nóng chảy: 42.5 độ C
-
Nhiệt độ phân hủy: 213 độ C.
-
Khối lượng riêng: 1.87 g/cm3
Tính chất hóa học của axit photphoric
Dưới đây là những tính chất hóa học đặc trưng của axit photphoric mà bạn cần nhớ.

Phân li thuận nghịch theo 3 nấc trong dung dịch
Axit photphoric là axit 3 nấc có độ mạnh trung bình. Trong dung dịch nước, H3PO4 sẽ phân li thuận nghịch theo 3 nấc như sau:
-
Nấc 1: H3PO4 ↔ H+ + H2PO4- (Sự phân li chủ yếu)
-
Nấc 2: H2PO4- ↔ H+ + HPO4(2-) (Sự phân li kém hơn)
-
Nấc 3: HPO4(2-) ↔ H+ + PO4(3-) (Sự phân li rất yếu)
Như vậy, trong dung dịch Axit photphoric có các ion H+, H2PO4-, HPO4(2-), PO4(3-) và các phân tử H3PO4 không phân li.
Axit photphoric mang đầy đủ tính chất của 1 axit
Axit photphoric mang đầy đủ những tính chất hóa học của một axit, bao gồm:
-
Làm quỳ tím chuyển đỏ.
-
Tác dụng với oxit bazơ, tạo ra sản phẩm là muối và nước:
2H3PO4 + 3Na2O → 2Na3PO4 + 3H2O
-
Tác dụng với bazơ tạo ra muối và nước (các sản phẩm muối khác nhau tùy theo tỷ lệ phản ứng, chẳng hạn như muối axit, muối trung hòa hoặc hỗn hợp các loại muối đó).
Ví dụ:
KOH + H3PO4 → KH2PO4 + H2O
2KOH + H3PO4 → K2HPO4 + 2H2O
3KOH + H3PO4 → K3PO4 + 3H2O
-
Tác dụng với kim loại trước H2, tạo ra sản phẩm là muối và giải phóng H2:
Ví dụ: 2H3PO4 + 3Mg → Mg3(PO4)2 + 3H2
-
Tác dụng với muối tạo ra muối mới + axit mới:
Ví dụ: H3PO4 + 3AgNO3 → 3HNO3 + Ag3PO4
-
Phản ứng nhiệt phân: Ở nhiệt độ 200-250°C và 400-500°C, axit photphoric thể hiện tính oxi hóa-khử khi xảy ra phản ứng phân nhiệt.
2H3PO4 → H4P2O7 + H2O (nhiệt độ từ 200 đến 250 độ C)
H4P2O7 → 2HPO3 + H2O (nhiệt độ từ 400 đến 500 độ C)
Điều chế axit photphoric như thế nào?
Với những ứng dụng quan trọng trong các ngành công nghiệp sản xuất, đâu là cách axit photphoric được tạo ra? Cùng Monkey tìm hiểu cách điều chế loại axit này trong phòng thí nghiệm và trong công nghiệp.

Điều chế axit photphoric trong phòng thí nghiệm
Trong phòng thí nghiệm, axit photphoric được điều chế bằng cách dùng axit nitric HNO3 đặc oxy hóa photpho ở nhiệt độ cao:
P + 5HNO3 (đặc) → H3PO4 + 5NO2 + H2O (nhiệt độ)
Sản xuất axit photphoric trong công nghiệp
Trong công nghiệp, axit photphoric được sản xuất theo 2 phương pháp: Phương pháp khô và phương pháp ướt.
-
Phương pháp ướt (phương pháp trích ly)
Đây là cách dùng axit sunfuric đặc tác dụng với quặng photphotit hoặc quặng apatit:
Ca3(PO4)2 + 3H2SO4 (đặc) → 3CaSO4 (kết tủa) + 2H3PO4 (nhiệt độ)
Sau đó, H3PO4 tạo thành được tách khỏi kết tủa bằng cách lọc và được cô đặc. Tuy nhiên, axit H3PO4 thu được bằng phương pháp này không tinh khiết. Để thu được axit tinh khiết với nồng độ cao hơn, người ra thường sử dụng phương pháp khô.
-
Phương pháp khô (quá trình nhiệt)
Người ta đốt cháy phospho để tạo photpho pentaoxit P2O5, sau đó cho P2O5 tiếp tục phản ứng với nước, sản phẩm thu được là H3PO4 tinh khiết.
P → P2O5 → H3PO4
4P + 5O2 → 2P2O5 (nhiệt độ)
P2O5 + 3H2O → 2H3PO4
Xem thêm:
- Muối amoni: Chi tiết lý thuyết và bài tập kèm lời giải
- Muối photphat: Chi tiết lý thuyết và hướng dẫn giải bài tập
Những ứng dụng nổi bật của axit photphoric
Sau khi nắm được cấu tạo, tính chất vật lý, hóa học và phương pháp điều chế axit photphoric, ở phần này, chúng ta cùng tìm hiểu những ứng dụng nổi bật của H3PO4 trong thực tiễn.
.jpg)
Ứng dụng axit photphoric trong nông nghiệp
Trong nông nghiệp, một lượng lớn Axit photphoric được dùng để sản xuất phân bón. H3PO4 đậm đặc có thể chứa tới 70%-75% P2O5 - một nguyên liệu vô cùng quan trọng trong việc điều chế muối photphat, sản xuất phân lân, hợp chất photpho (trong thuốc trừ sâu), thức ăn cho gia súc...
Ứng dụng của axit photphoric trong công nghiệp
Axit Photphoric có đóng góp quan trọng trong ngành công nghiệp với những ứng dụng điển hình như:
-
Chất phụ gia: Axit photphoric là một loại chất phụ gia trong các loại đồ uống, mứt, thạch rau câu, pho mát… Bên cạnh đó, nó còn có thể tạo hương thơm, tạo thêm vị ngọt, sự đậm đà cho thực phẩm bằng cách kết hợp với Hfcs (đã xử lý enzymem).
-
Chất chống ăn mòn: Đây còn là chất tẩm gỗ chống cháy và chất chống ăn mòn kim loại. Axit photphoric là nguyên liệu sản xuất thuỷ tinh gạch men, xử lý nước, công nghiệp xi mạ, sản xuất các chất giặt tẩy…
-
Chất bảo quản: H3PO4 có khả năng làm chậm sự phát triển của vi khuẩn, nấm mốc trong công thức đường nên được sử dụng để làm chất bảo quản.
-
Sản xuất các sản phẩm từ sữa: Axit photphoric còn được sử dụng để sản xuất các sản phẩm từ sữa. Muối của loại axit này có khả năng thay đổi protein, độ pH để cải thiện chất lượng của sản phẩm. Sữa, bơ và phô mai… là những ví dụ điển hình các sản phẩm từ sữa có chứa axit photphoric.
-
Dược phẩm: Đồng thời, H3PO4 còn được sử dụng trong dược phẩm.
Những lưu ý khi sử dụng axit photphoric
Axit photphoric được ứng dụng khá quan trọng trong các ngành công nghiệp, nông nghiệp. Tuy nhiên, chúng ta cần phải khẳng định lại: Axit photphoric là một loại axit độc, gây nhiều hậu quả nguy hiểm đến sức khỏe nếu sử dụng chúng sai cách.

-
Axit photphoric rất dễ bay hơi. Cay mắt, bỏng giác mạc, suy hô hấp, gây cháy nổ, kích ứng nguy hiểm… là những triệu chứng nguy hiểm khi chúng ta tiếp xúc trực tiếp với H3PO4 qua da. Do đó, trong quá trình sử dụng axit photphoric, bạn cần trang bị đầy đủ đồ bảo hộ an toàn và những kiến thức về cách sử dụng loại axit này.
-
H3PO4 là một loại nguyên liệu có trong nước ngọt, nó cũng là một trong những yếu tố nguy cơ làm giảm mật độ xương. Vì vậy, bạn nên hạn chế tối đa uống các loại đồ uống ngọt đóng chai chứa loại axit này.
-
H3PO4 có khả năng phản ứng ở nhiệt độ cao, rất dễ gây cháy nổ. Vì thế, khi sử dụng xong axit này, bạn cần đóng bình cẩn thận và bảo quản chúng ở nơi khô ráo, tránh ánh nắng mặt trời.
-
Bên cạnh đó, H3PO4 được sử dụng trong nhiều loại thực phẩm khác nhau, lượng Photpho trong các loại thức ăn này có thể khiến bạn tăng nguy cơ mắc các bệnh về sỏi thận, tiết niệu,…Vì vậy, hãy đọc kỹ các thành phần có trong thực phẩm ăn nhanh và hạn chế sử dụng chúng. Đây là một trong những nguy cơ tiềm ẩn có thể gây hại cho sức khỏe của bạn.
Bài tập về axit photphoric SGK Hóa học 11 kèm lời giải chi tiết
Để nắm chắc kiến thức về axit photphoric, cùng Monkey vận dụng những lý thuyết đã học trên để thực hành một số bài tập cơ bản về axit photphoric trong SGK Hóa học 11 sau đây.
.jpg)
Giải bài 1 trang 53 SGK Hóa 11
Viết phương trình hoá học dạng phân tử và dạng ion rút gọn của phản ứng giữa axit photphoric với lượng dư của:
a. BaO ; b. Ca(OH)2 ; c. K2CO3
Lời giải:
Các chất lấy dư nên muối tạo ra là muối trung hoà:
a. 2H3PO4 + 3BaO → Ba3(PO4)2 + 3H2O
Phương trình phân tử trùng với phương trình ion thu gọn
b. 2H3PO4 + 3Ca(OH)2 → Ca3(PO4)2 + 6H2O
2H3PO4 + 3Ca2+ + 6OH- → Ca3(PO4)2 + 6H2O
c. 2H3PO4 + 3K2CO3 → 2K3PO4 + 3H2O + 3CO2↑
2H3PO4 + 3CO32- → 2PO43- + 3H2O + CO2↑
Giải bài 2 SGK Hóa 11 trang 53
Nêu những điểm giống nhau và khác nhau về tính chất hoá học giữa axit nitric và axit photphoric. Dẫn ra những phản ứng hoá học để minh hoạ?
Lời giải:
Những tính chất chung: Đều có tính axit
-
Chuyển màu chất chỉ thị: Quỳ tím chuyển thành màu đỏ.
-
Tác dụng với bazơ, oxit bazơ không có tính khử (các nguyên tố có số oxi hoá cao nhất):
3NaOH + H3PO4 → Na3PO4 + 3H2O
Fe2O3 + 6HNO3 → 2Fe(NO3)3 + 3H2O
-
Tác dụng với một số muối của axit yếu và không có tính khử:
2HNO3 + CaCO3 → Ca(NO3)2 + H2O + CO2↑
2H3PO4 + 3Na2SO3 → 2Na3PO4 + 3H2O + 3SO2↑
Những tính chất khác nhau:

Giải bài 3 SGK trang 54 Hóa 11
Phương trình điện li tổng cộng của H3PO4 trong dung dịch là:
H3PO4 ⇆ 3H+ + PO43-
Khi thêm HCl vào dung dịch:
A. Cân bằng trên chuyển dịch theo chiều thuận.
B. Cân bằng trên chuyển dịch theo chiều nghịch.
C. Cân bằng trên không bị dịch chuyển.
D. Nồng độ PO43- tăng lên.
Lời giải: Đáp án B.
Khi thêm HCl vào làm tăng nồng độ H+ trong dung dịch. Theo nguyên lí chuyển dịch cân bằng, cân bằng chuyển dịch theo chiều làm giảm nồng độ H+
⇒ cân bằng chuyển dịch theo chiều nghịch.
Giải bài 4 trang 54 Hóa 11 SGK
a) Lập các phương trình hóa học sau đây:
a. H3PO4 + K2HPO4 →
1 mol 1mol
b. H3PO4 + NaOH →
1 mol 1mol
c. H3PO4 + Ca(OH)2 →
2mol 1mol
d. H3PO4 + Ca(OH)2 →
2mol 3mol
Lời giải:
a. H3PO4 + K2HPO4 → 2KH2PO4
1 mol 1mol
b. H3PO4 + Ca(OH)2 → CaHPO4 + 2H2O
1 mol 1mol
c. 2H3PO4 + Ca(OH)2 → Ca(H2PO4)2 + 2H2O
2mol 1mol
d. 2H3PO4 + 3Ca(OH)2 → Ca3(PO4)2 + 6H2O
2mol 3mol
Axit photphoric là một trong những bài học quan trọng trong chương trình Hóa học THPT. Hy vọng bài viết này sẽ giúp bạn nắm chắc những kiến thức cơ bản nhất về H3PO4. Đừng quên áp dụng nó trong các bài tập thực hành môn Hóa học để nắm vững bài học này nhé. Monkey chúc bạn đạt kết quả cao trong học tập!
Phosphoric acid - Ngày truy cập: 23/7/2022
https://en.wikipedia.org/wiki/Phosphoric_acid
Phosphoric acid - Ngày truy cập: 23/7/2022






.jpg)
.png)
.png)






.png)